Bases biomécaniques et neurologiques de la locomotion
Le cycle de marche
Un consensus a été établi afin de définir le cycle de marche et ainsi de pouvoir décrire les marches normales et pathologiques à partir d'un cycle standardisé. Un cycle de marche est défini pour un membre inférieur. Il débute par le contact initial de l'un des pieds au sol et se termine par le contact initial suivant de ce même pied. Il est composé de deux pas, soit une foulée, un pas se terminant lors du contact initial du pied controlatéral.
Les différentes phases
Un cycle de marche comporte deux phases : une phase d'appui ou de support et une phase d'oscillation. La durée de ces phases est exprimée en pourcentage de la durée totale du cycle de marche, ce qui permet notamment d'analyser ces durées indépendamment des vitesses de marche employées. La phase d'appui correspond, comme son nom l'indique, à la période pendant laquelle le pied concerné est en contact avec le sol. Elle représente 60 % du cycle de marche. Pendant la phase d'oscillation, qui constitue les 40 % restants, le pied n'est plus en contact avec le sol et le membre avance.
La phase d'appui étant plus longue que la phase d'oscillation, il existe inéluctablement lors du cycle de marche des périodes de double appui (c'est-à-dire des périodes où les deux membres inférieurs sont en phase d'appui, n'existant pas lors de la course). Prenons l'exemple du cycle du pied droit. Lorsque le pied droit attaque le sol, le pied gauche est déjà en phase d'appui. Le pied droit est donc dès le début de son cycle en phase de double appui et y reste jusqu'à 10 % du cycle. Dès le décollement du pied gauche, le pied droit entre en phase de simple appui. Le pied droit est alors en simple appui entre 10 et 50 % du cycle (soit pendant les 40 % correspondant à la phase oscillante du membre inférieur gauche). Lors de l'attaque du pied gauche, le pied droit est de nouveau en phase de double appui jusqu'en fin de phase d'appui . À 60 % du cycle, il entre en phase oscillante , laissant ainsi le membre inférieur gauche en phase de simple appui (fig. 5.1 ; Kirtley, 2006).
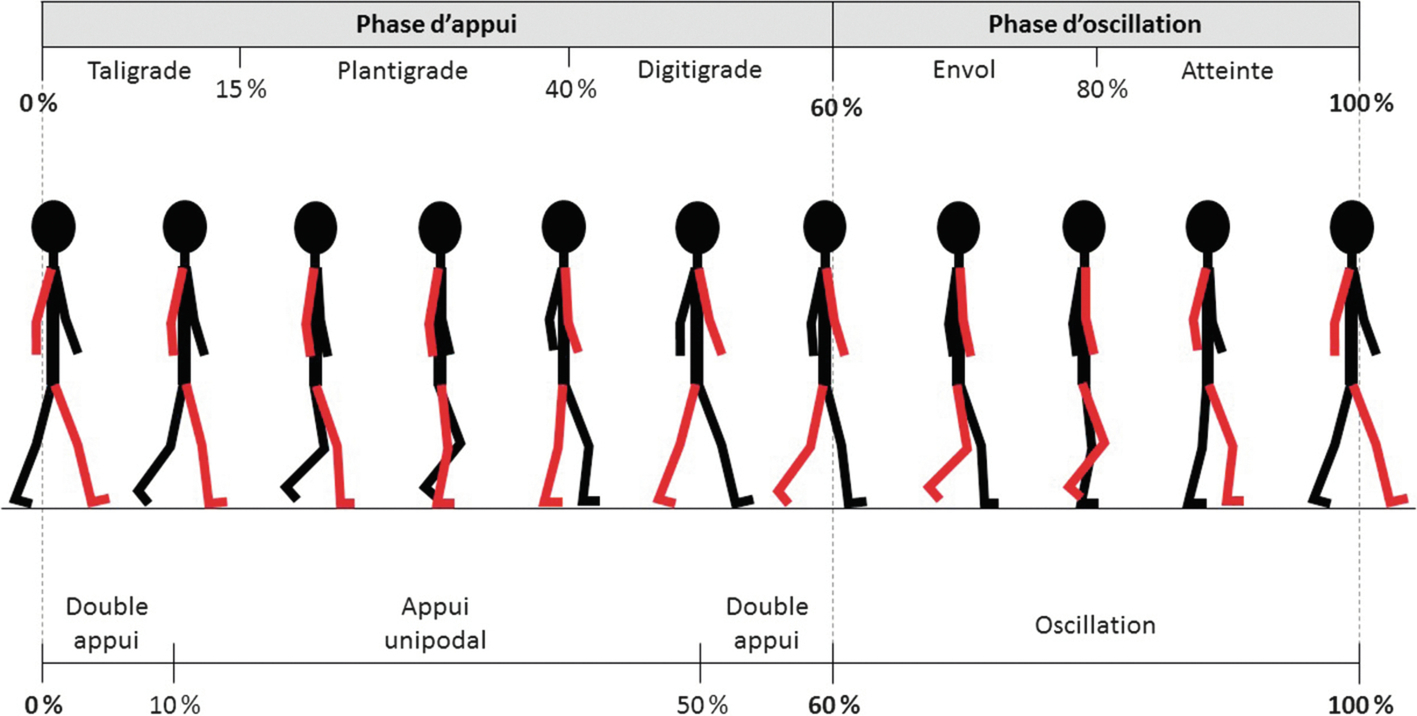
Les phases d'appui et d'oscillation peuvent être elles-mêmes subdivisées. En effet, la phase d'appui est décomposée en :
- ● une phase taligrade (0 à 15 %), où le talon entre en contact avec le sol ;
- ● une phase plantigrade (15 à 40 %), où l'ensemble du pied repose sur le sol ;
- ● une phase digitigrade (40 à 60 %), où le talon quitte le sol et où l'appui se fait alors sur l'avant-pied.
La phase d'oscillation est fragmentée en :
- ● une phase d'oscillation initiale ou envol (60 à 80 %), qui débute dès que le pied quitte le sol et correspond à la première moitié de la phase oscillante ;
- ● une phase d'oscillation terminale ou atteinte (80 à 100 %), qui correspond à la seconde moitié de phase oscillante.
Par ailleurs, la marche est associée à des oscillations des membres supérieurs. La première moitié du cycle de marche d'un membre inférieur est associée à une avancée du membre supérieur ipsilatéral, alors que la seconde moitié d'un cycle est associée à un recul du membre supérieur ipsilatéral. Les membres supérieurs oscillent ainsi en permanence lors de la marche, en antiphase (c'est-à-dire en alternance, l'un allant vers l'arrière lorsque l'autre avance, et vice versa). L'avancée d'un membre inférieur est donc concomitante à l'avancée du membre supérieur controlatéral, ainsi qu'au recul du membre supérieur ipsilatéral (fig. 5.1).
L'opposition observée entre l'orientation de la ceinture scapulaire et celle de la ceinture pelvienne est appelée dissociation des ceintures. La rotation nécessaire à cette dissociation se produit autour de l'axe vertical et n'a pas lieu au niveau d'une vertèbre particulière (Crosbie, Vachalathitib et Smith, 1997).
Analyse quantifiée de la marche
Il existe différentes méthodes pour analyser la marche. En particulier, l'analyse quantifiée de la marche (AQM) permet de recueillir des données cinétiques (les forces mises en jeu), cinématiques (les angles articulaires) et électromyographiques (activité musculaire). Malgré l'importance du temps et du matériel nécessaires pour la réaliser, elle présente un intérêt clinique puisqu'elle s'intéresse à une situation fonctionnelle et qu'elle permet de mieux comprendre l'origine de certains troubles de la marche liés à des lésions neurologiques ou orthopédiques, comme les amputations (Whittle, 1996). De plus, elle oriente le choix thérapeutique (Kay et al., 2000).
Par exemple, chez le paralysé cérébral, l'AQM peut permettre de distinguer les anomalies primaires des troubles secondaires ou tertiaires, et de choisir ainsi le type d'intervention (chirurgie orthopédique, toxine botulique, kinésithérapie). DeLuca, Davis III, &unpuu, Rose et Sirkin (1997) ont constaté une modification des indications opératoires après AQM chez 52 % des enfants paralysés cérébraux appartenant à l'étude.
Par ailleurs, chez le patient hémiparétique, l'AQM peut permettre d'identifier précisément la déficience à l'origine d'un handicap fonctionnel (un défaut de flexion dorsale en phase oscillante, par exemple, peut être dû à une paralysie du tibial antérieur, mais aussi à une rétraction du triceps).
Face à la variabilité des étiologies des accidents vasculaires cérébraux et des troubles causés, il est primordial de définir les déficiences initiales afin d'assurer une prise en charge fondée sur le traitement des causes primaires du handicap.
Cinétique de la marche
La cinétique de la marche correspond à l'analyse des forces mises en jeu. Elle peut être obtenue à partir d'une plateforme de force.
En marchant sur la plateforme, le sujet génère des forces qui sont associées à des forces de réaction du support (ou forces de réaction au sol). La plateforme enregistre les trois composantes de la force de réaction au sol : verticale, antéro-postérieure et médio-latérale (fig. 5.2).
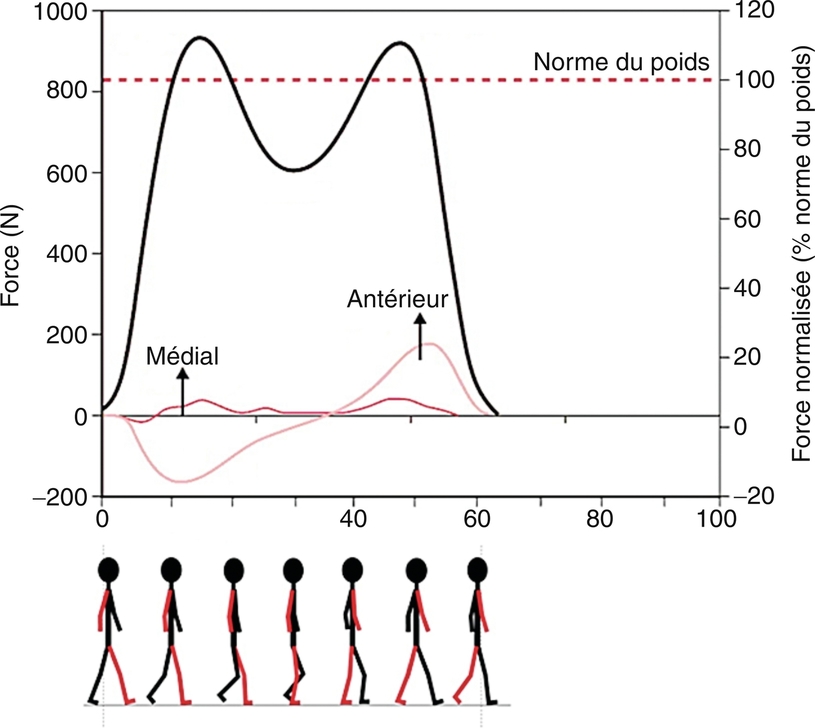
En noir, la composante verticale et en rouge, les composantes antéro-postérieure et médio-latérale. Source : d'après Kirtley, C. (2006) . Clinical gait analysis : theory and practice. Elsevier.
La composante verticale présente deux pics atteignant environ 1,1 fois le poids du corps. Une forte augmentation de la valeur de la force pendant la phase de double appui, due au transfert du poids sur le pied qui entre en phase d'appui, induit l'atteinte du premier pic au début de la phase unipodale. Ensuite, cette valeur diminue du fait de l'oscillation du membre controlatéral, avant d'augmenter à nouveau pour atteindre le second pic, juste avant le deuxième double appui .
Plus le genou du membre d'appui est rigide, plus cette force est importante et plus les forces engendrées sur les structures musculo-squelettiques le sont (Pandy, 2003).
La composante antéro-postérieure est négative pendant la première moitié de la phase d'appui. Ainsi, elle est orientée dans le sens opposé à la marche et est donc frénatrice. Au contraire, elle est positive et donc propulsive au cours de la seconde moitié de cette phase. La composante médio-latérale est latérale pendant le premier double appui puis médiale le reste de la phase d'appui, en réponse au déplacement de l'autre côté du corps (Anderson et Pandy, 2001).
Le plateau de force donne les forces de réaction au sol et les moments des forces dans les directions de l'espace (c'est-à-dire antéro-postérieure, médio-latérale et verticale). En réalité, une multitude de points d'application existent pour couvrir toute la surface de contact du pied sur le sol. Mais par calcul, on peut définir pour simplifier un point virtuel, centre des pressions (CP), qui correspond au barycentre des composantes verticales de cette force réparties sur toute la surface de contact entre le pied et sol.
En marche normale, pendant la phase d'appui, le CP se déplace depuis le bord latéral du talon jusqu'à la phalange distale de l'hallux en passant par le bord latéral du pied puis par les têtes des métatarsiens. Chez le patient hémiparétique, la distance parcourue par le CP dans le plan antéro-postérieur est plus courte sur le membre atteint, ce qui signifie que la longueur du pas est plus courte. Le temps d'appui unipodal y est plus faible avec un appui sur l'avant-pied plus bref. Dans le plan médio-latéral, le déplacement du CP est plus important sur le membre sain, ce qui suggère une difficulté à la réalisation de l'oscillation du membre parétique.
Il est important de distinguer le CP du centre de gravité (CG). Tout comme le CP, le CG est un point virtuel que l'on définit pour simplifier et ne considérer qu'un point d'application de la résultante des forces de pesanteur. Lors de la marche, les mouvements verticaux du CG sont maîtrisés afin d'être aussi faibles que possible grâce notamment à une flexion du genou maintenue et aux rotations et inclinaisons du bassin. Plus ils sont minimes, plus la marche est économique. Une pathologie altérant le schéma de marche induit donc inévitablement une augmentation de son coût énergétique (Saunders, Inman et Eberhart, 1953 ; Lin, Gfoehler et Pandy, 2014).
Amplitudes articulaires (cinématique)
Lors de la marche, les mouvements du bassin se font essentiellement dans les plans frontal et transversal. Dans le premier, une inclinaison du côté oscillant s'oppose à celle des épaules. Dans le plan transversal, une giration pelvienne du côté de l'appui, de l'ordre de 10°, s'oppose au mouvement de la ceinture scapulaire.
La hanche est en flexion de 30° lors du contact initial avec le sol. Puis une extension progressive est réalisée, la rectitude étant atteinte pendant la phase plantigrade et l'extension maximale de 10° au milieu de la phase digitigrade. Enfin, la hanche se fléchit pendant la phase d'oscillation afin d'assurer l'absence de contact avec le sol en raccourcissant le membre. Un déficit d'extension peut être compensé par une flexion du tronc lors de la phase d'appui (fig. 5.3).
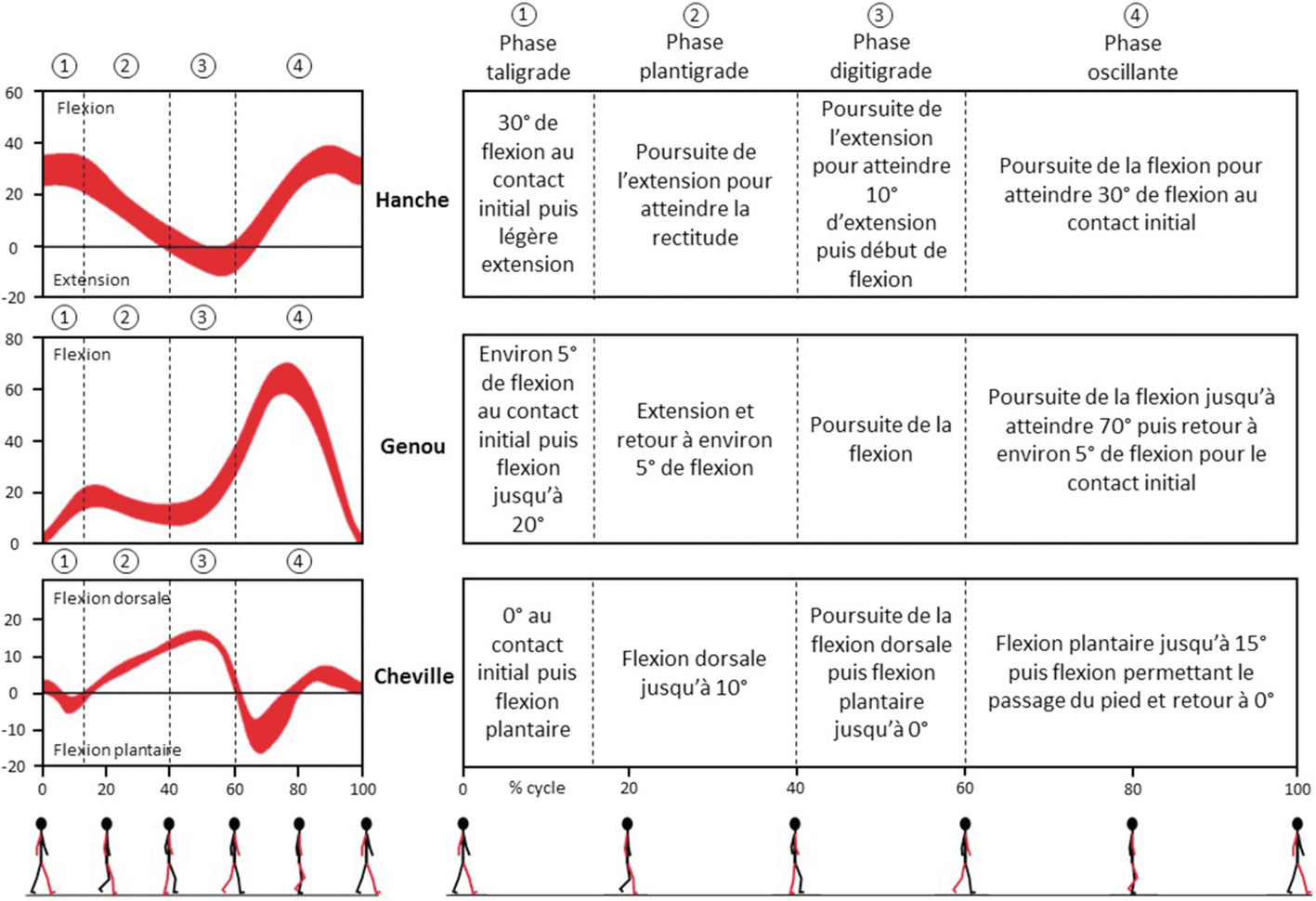
Le genou est en flexion pendant la totalité du cycle de marche. À l'attaque du pied au sol, cette flexion est très faible, de l'ordre de 5°. Elle augmente de 15 à 20° pendant la phase taligrade, puis diminue avant d'augmenter à nouveau pendant la phase digitigrade. Le maximum de flexion est atteint pendant la phase d'envol, il est de 70°, ce qui permet également de raccourcir le membre pour le passage du pas. Pour finir, lors de l'atteinte, le genou réalise une extension pour préparer la nouvelle phase d'appui. Un déficit de flexion articulaire perturbe la phase d'oscillation (fig. 5.3).
La cheville est en position neutre lors du contact initial avec le sol. Puis une flexion plantaire permet de « stabiliser l'appui », en amenant le pied à plat au sol. Au cours de la phase plantigrade, la flexion dorsale est liée au mouvement du segment jambier par rapport au pied, elle atteint 10°. Ensuite, pendant la phase digitigrade, la flexion plantaire est liée à la propulsion, elle est de 15° au début de la phase d'oscillation. C'est lors de cette phase que pour finir la cheville retourne à sa position neutre (fig. 5.3 ; Anderson et Pandy, 2001 ; Kirtley, 2006).
Activité musculaire (électromyogramme dynamique)
L'activité des différents muscles (fig. 5.4) peut être recueillie de manière non invasive par électromyogramme (EMG) de surface. Lors de la marche, les amplitudes des signaux sont faibles, permettant un faible coût énergique. L'activité des muscles induit des mouvements sur de faibles amplitudes et majoritairement sur un mode excentrique freinateur. Ceci permet d'éviter la chute, la marche consistant comme dit précédemment en un déséquilibre avant.

L'objectif de l'EMG dynamique de la marche est avant tout d'obtenir les séquences temporelles d'activation musculaire, ce qui permet par la suite de distinguer les contractions « normales » des contractions pathologiques.
Les abducteurs de hanche (petit fessier , moyen fessier et tenseur du fascia lata ) agissent tout au long de la phase d'appui afin de stabiliser la hanche et le bassin. Un déficit du moyen fessier entraîne la chute de l'hémi-bassin du côté oscillant.
Les fléchisseurs de hanche (ilio-psoas ) agissent pendant la phase d'oscillation avec un mode concentrique afin de permettre le passage du pied (fig. 5.4). Par conséquent, une faiblesse des fléchisseurs limite l'oscillation et peut entraîner une diminution de la longueur du pas. Ce déficit peut être compensé par une extension du tronc ou une antéversion du bassin.
Les quatre chefs du quadriceps et les ischio-jambiers (fig. 5.4) sont extenseurs de genou lors de la phase taligrade . Seuls les trois vastes sont actifs pendant la phase plantigrade. Enfin, ces muscles n'ont aucune action au cours de la phase digitigrade . Une déficience du quadriceps cause une instabilité lors de la phase d'appui. Au contraire, une hypertonie du droit fémoral perturbe la phase d'oscillation en limitant la flexion du genou. Pendant la phase d'oscillation, les ischio-jambiers sont actifs, ils permettent d'éviter le fauchage en raccourcissant le membre par la flexion du genou. Les trois vastes sont à nouveau actifs les derniers 10 % de la phase d'oscillation pour tendre la jambe et préparer l'attaque du pied au sol.
Les muscles triceps suraux (fig. 5.4) et rétromalléolaires latéraux sont sollicités lors de la phase plantigrade. L'amplitude EMG du triceps sural augmente du début de la phase plantigrade à la fin de la phase d'appui. Le triceps sural a alors un triple rôle : il assure une fonction antigravitaire permettant de rester en station érigée ; il s'associe aux muscles rétromalléolaires latéraux pour stabiliser la cheville dans le plan frontal ; enfin, il est impliqué dans la propulsion vers l'avant. Notons toutefois que cette fonction ne semble pas clairement élucidée dans la littérature. En effet, si de nombreuses études associent le triceps sural à la propulsion du corps en fin de phase d'appui, d'autres études récentes suggèrent que la marche serait une chute constante vers l'avant dont l'accélération serait provoquée par les muscles extenseurs du membre inférieur d'appui. La contraction du triceps sural en fin de phase d'appui aurait un rôle freinateur contrôlant cette chute (Gillet et al., 2003 ; Neptune, Zajac et Kautz, 2004).
Les releveurs de pied sont actifs pendant toute la phase d'oscillation, ils préparent l'attaque par le talon. Puis pendant la phase taligrade, sur un mode excentrique, ils freinent le déroulement du pied. Un déficit des releveurs et/ou une hypertonie des fléchisseurs plantaires peuvent entraîner un steppage.
Paramètres spatio-temporels
Contrairement à l'AQM, qui nécessite du matériel spécialisé et onéreux puis un traitement des données, la mesure des paramètres spatio-temporels est rapide, à faible coût et facile. De plus, ces paramètres constituent des indicateurs de suivi, permettant d'objectiver les performances des sujets.
La fréquence de pas correspond au nombre de pas par unité de temps. Si cette unité est la minute, elle est communément appelée cadence. Un sujet sain réalise en moyenne 100 à 130 pas par minute.
La longueur de pas est la distance dans le plan antéro-postérieur séparant les positions d'un même point du pied entre le début et la fin du pas. Elle est en moyenne de 80 cm. Une diminution de la longueur de pas est retrouvée en cas de syndrome parkinsonien .
La vitesse de marche est le produit de la fréquence et de la longueur de pas. Il existe pour chaque sujet une vitesse de confort, correspondant à la vitesse à laquelle la dépense énergétique est minimale. Cette vitesse est en moyenne de 1,3 à 1,6 m/s.
Avec Lp en mètres et Fp en secondes.
Ces trois paramètres spatio-temporels peuvent être cliniquement interprétés. Le premier affecté par la plupart des pathologies est la longueur du pas. Sa réduction peut être liée à une faiblesse, paralysie, hypertonie ou rétraction musculaire, à une déformation du pied ou encore à une douleur. Elle entraîne par définition une diminution de la vitesse de marche, sauf si elle est compensée par une augmentation de la fréquence de pas. On parle alors de marche compensée. Si ce n'est pas le cas, on parle de marche pathologique sévère.
Chez les hémiplégiques, certains traitements ont été démontrés comme efficaces pour augmenter la vitesse de marche. En effet, une diminution du tonus musculaire du triceps sural et du tibial postérieur après injection de toxine botulique permet une augmentation de la longueur de pas et ainsi de la vitesse de marche (Hesse et al., 1994). Il en est de même pour le renforcement musculaire du membre inférieur atteint, mais aussi du membre inférieur sain (Teixeira-salmela, Nadeau, Mcbride et Olney, 2001).
La largeur du pas est la distance séparant la partie médiane du talon du point de la ligne de l'axe de marche le plus proche. Elle est en moyenne de 5 à 6 cm. Les patients souffrant d'ataxie cérébelleuse présentent une largeur de pas significativement plus importante que les sujets sains (p < 0,05 ; Martino et al., 2014).
Le temps d'appui unipodal correspond comme son nom l'indique à la durée au cours d'un cycle pendant laquelle le pied concerné est le seul à être en contact avec le sol. Il correspond au temps oscillant du membre controlatéral et peut être exprimé en unité de temps ou en pourcentage du cycle de marche. Chez le sujet hémiplégique, la durée d'appui sur le membre atteint est diminuée.
Pour aller plus loin : la marche arrière
Lorsqu'il est demandé à un individu de marcher en arrière, le mouvement mis en place est extrêmement proche de la marche avant. Une vidéo inversée d'une personne marchant en arrière est même difficile à distinguer d'une vidéo de cette même personne marchant en avant (Viviani, Figliozzi, Campione et Lacquaniti, 2011). La cinématique est en fait semblable dans les deux cas. En effet, si le cycle de marche avant est constitué d'une succession des phases taligrade, plantigrade, digitigrade et oscillante, le cycle de marche arrière est constitué des mêmes phases en ordre inverse. Ainsi, les courbes décrivant les amplitudes articulaires observées dans le plan sagittal en marche arrière sont quasiment des images en miroir de celles correspondant à la marche avant, et en particulier en ce qui concerne la hanche, le genou et l'épaule. L'évolution de l'amplitude articulaire de cheville en marche arrière reste très proche de celle observée en marche avant, mais le pic de flexion plantaire est beaucoup moins important (Winter, Pluck et Yang, 1989).
En ce qui concerne l'activité musculaire, davantage de différences existent. Au niveau des principaux muscles des membres inférieurs, les amplitudes EMG observées sont différentes (fig. 5.5).

Cela peut s'expliquer par une inversion entre les tâches excentriques et concentriques (Winter et al., 1989). Certains schémas temporels d'activation communs sont tout de même retrouvés, mais ne concernent pas les mêmes muscles (Ivanenko, Cappellini, Poppele et Lacquaniti, 2008).
Du fait de l'ensemble de ces points communs, il a été suggéré que ces deux modes de locomotion pourraient partager des mécanismes nerveux communs. Toutefois, aucun consensus n'est encore établi à ce sujet.
L'existence d'un grand nombre de similitudes entre la marche avant et la marche arrière a également conduit les thérapeutes à utiliser la marche arrière comme un outil de rééducation pour des pathologies variées. La marche arrière est utilisée en tant qu'outil de rééducation de l'équilibre. En effet, les afférences visuelles ne peuvent pas être exploitées, et les autres sources d'information sensorielle (cutanées, proprioceptives et vestibulaires) sont davantage sollicitées. De plus, en rééducation neurologique, la marche arrière peut être utilisée pour restaurer le schéma de marche et diminuer l'apparition de mouvement parasite. Par exemple, en cas de handicap neurologique, une triple flexion excessive peut exister tout au long du cycle de marche. Le positionnement du pied en arrière du corps permet alors de restaurer un schéma de marche où la flexion de genou peut être associée à une extension de hanche et de cheville. Les patients ayant suivi ce type d'entraînement transfèrent ensuite les compétences acquises vers la marche avant. En effet, plusieurs paramètres (tels que la longueur du pas et la vitesse de marche) s'améliorent suite à des entraînements en marche arrière (Hoogkamer, Meyns et Duysens, 2014).
Enfin, la marche arrière est utilisée en traumatologie et en rhumatologie en cas de lésions du genou. En effet, les forces de réaction au sol et les forces de compression au niveau de l'articulation fémoro-patellaire sont moindres en marche arrière et en course arrière.
De plus, l'amplitude d'activation du quadriceps est plus importante en course arrière, ce qui assure une meilleure stabilité du ligament croisé antérieur. La course arrière peut ainsi être utilisée en tant qu'entraînement cardiorespiratoire, de manière moins traumatisante pour le genou que la course avant.
Contrôle neurologique de la marche
Si elle paraît simple pour celui qui l'exécute, la marche est en fait une activité complexe, constituée de répétitions cycliques précises, demeurant toutefois adaptable aux perturbations. Elle résulte ainsi, sur le plan neurologique, d'une fine régulation entre plusieurs systèmes : les structures supra-spinales, les générateurs de rythme spinaux (communément appelés CPG pour central pattern generator ) et les systèmes sensoriels (Zehr et Duysens, 2004 ; Grillner, 2006).
Les structures supra-spinales régulent l'activité des générateurs de rythme spinaux, qui génèrent des mouvements rythmiques au niveau des membres inférieurs et supérieurs. Les systèmes sensoriels permettent l'adaptation de la marche aux contraintes extérieures (fig. 5.6).

CPG : central pattern generator.
Générateurs de rythme spinaux
Les générateurs de rythme spinaux (central pattern generator ou CPG) correspondent à des groupes de neurones appartenant à la moelle épinière et impliqués dans la génération de mouvements rythmiques, tels que la locomotion, la mastication ou encore la respiration.
Leur existence a été objectivée par de nombreuses études chez plusieurs animaux, comme la lamproie, la salamandre, le chat ou encore le singe.
D'autres études suggèrent fortement leur existence chez l'homme, bien que leur nature exacte ne soit pas encore caractérisée avec précision (Guertin, 2013).
Il y a environ un siècle, Sherrington (Sherrington, 1910) a montré qu'un chat décérébré 1 pouvait produire des mouvements rythmiques. Par la suite, Brown (1911) a montré que des chats désafférentés 2 alternaient également des mouvements de flexion et d'extension des membres postérieurs, suite à une section complète de la moelle épinière au niveau thoracique bas. Ces expériences ont permis d'établir qu'une activation alternée de muscles agonistes et antagonistes pouvait survenir sans efférences corticales et sans afférences sensitives. Brown a ainsi proposé l'existence de réseaux de neurones spinaux capables de produire une activité musculaire alternée entre muscles agonistes et antagonistes de manière autonome (Brown, 1914). Le modèle proposé par Brown est nommé half-centered model ou modèle des demi-centres.
Il correspond à l'existence d'un demi-centre activant les muscles fléchisseurs et d'un demi-centre activant les muscles extenseurs, chacun de ces centres interagissant avec l'autre par inhibition réciproque (fig. 5.7). L'activité de l'un des demi-centres inhiberait celle de l'autre puis s'arrêterait par fatigue, laissant ainsi place à celle de l'autre demi-centre.

En 1966, Shik, Severin et Orlovskii ont effectué de nouvelles études sur des chats n'ayant plus d'efférences corticales par l'intermédiaire de chats mésencéphaliques 3 . Ils ont montré qu'une microstimulation électrique d'une zone du tronc cérébral suffisait à déclencher chez le chat une marche au pas, au trot ou au galop. De manière surprenante, l'augmentation de l'intensité de la stimulation déclenchait même la transition d'une allure à l'autre (Shik et al., 1966). La zone ainsi identifiée, appartenant au mésencéphale, a été nommée « région locomotrice mésencéphalique » ou MLR pour mesencephalic locomotor region, et a été ensuite identifiée chez de nombreux animaux, dont le singe (Ryczko et Dubuc, 2013). Ces découvertes ont confirmé que des structures supra-spinales permettaient de déclencher l'activité des générateurs de patterns 4 chez les mammifères.
Les études de Grillner sur des modèles animaux ont ensuite permis d'enrichir le modèle initialement proposé par Brown et de proposer les générateurs de rythme centraux ou CPG.
En effet, Grillner a de nouveau étudié des chats mésencéphaliques désafférentés en stimulant la MLR, et a conclu que leur activité EMG était plus complexe qu'une alternance de flexion et d'extension de l'ensemble du membre inférieur (le muscle semi-tendineux, par exemple, bi-articulaire, ne montre qu'une courte activité qui ne dure pas pendant toute la phase oscillante, alors que c'est le cas d'un fléchisseur pur, comme l'ilio-psoas).
Ainsi, selon Grillner, les programmes centraux permettent de générer un pattern plus complexe que celui proposé par Brown, consistant en l'activation séquentielle des bons muscles, aux bons moments et pendant une durée précise (Grillner et Zangger, 1975).
Aujourd'hui, les CPG sont majoritairement considérés comme des groupes d'interneurones existant à plusieurs niveaux d'organisation et permettant de générer une marche stéréotypée (les afférences sensorielles étant nécessaires pour rendre la marche adaptable aux contraintes).
Le modèle de Grillner concernant les quadrupèdes (fig. 5.8) considère l'existence d'un CPG par membre, lui-même divisé en CPG unitaires contrôlant chacun les muscles synergiques d'une articulation.

Les CPG des membres gauches et droits peuvent interagir selon différents modes de coordination, chaque côté du corps pouvant être en phase (c'est-à-dire suivre le même pattern en même temps, comme dans l'exemple du galop) ou en antiphase (c'est-à-dire agir en alternance, comme dans l'exemple du pas).
Le pattern d'un membre résulte ensuite de l'interaction entre les différents CPG unitaires de chaque articulation. Le court extenseur des orteils a un pattern particulier et aurait donc son propre CPG (Grillner, 2006).
Si les études neurobiologiques conduites chez les animaux ne peuvent être mises en place chez l'homme, plusieurs phénomènes suggèrent fortement que des CPG soient également responsables de la génération de patterns pour l'être humain.
En particulier, Dimitrijeciv, Gerasimenko et Pinter (1998) ont étudié, chez des patients souffrant de paraplégie complète post-traumatique, l'effet d'une stimulation épidurale effectuée en dessous du niveau lésionnel. Ils ont conclu qu'une stimulation des structures postérieures du segment L2 générait une activité EMG rythmique du membre inférieur ipsilatéral caractéristique de l'activité observée lors de la marche.
Par ailleurs, plus récemment, Dominici et al. (2011) ont étudié l'activité EMG de nouveau-nés lors de l'exécution de mouvements rythmiques proches de la marche. En effet, les nouveau-nés sont capables d'exécuter des pas alternés s'ils sont soutenus en position érigée et si leurs pieds sont en contact avec le sol. L'activité EMG de 24 muscles des membres inférieurs et du tronc a été enregistrée. Parmi ces 24 activités musculaires, seulement deux motifs d'activation rythmique différents existaient. Ainsi, les muscles seraient répartis en deux groupes à cet âge, l'un étant activé en phase d'appui et l'autre en phase oscillante. Les motifs d'activation ainsi identifiés sont extrêmement proches de ceux observés chez des nouveau-nés rats. Au cours du développement, d'autres motifs d'activation apparaissent (séparant alors les muscles en quatre groupes) et sont différents de ceux des rats adultes. Ainsi, à la naissance, les mêmes prémices motrices pourraient exister chez les humains et d'autres espèces, mais être ensuite remodelées et peaufinées au cours du développement, de manière spécifique à chaque population.
Enfin, la coordination entre membres supérieurs et membres inférieurs chez l'homme est similaire à celle observée chez les animaux quadrupèdes. La coordination entre les quatre membres semble ainsi avoir été conservée au cours de l'évolution.
De plus, des mouvements rythmiques des membres inférieurs induisent, chez l'homme, une modulation des réflexes observée sur des muscles des membres supérieurs et vice versa.
Cette modulation n'apparaît qu'en cas de mouvement rythmique effectué activement, ce qui suggère qu'une commande envoyée aux membres inférieurs ait automatiquement un effet sur les membres supérieurs. Selon Falgairolle, de Seze, Juvin, Morin et Cazalets (2007), il existe ainsi probablement des CPG lombaires et cervicaux chez l'homme, interconnectés par des circuits réflexes, tels que décrits par Grillner (2006) pour les animaux quadrupèdes.
Contrôle supra-spinal des générateurs de rythme spinaux
Si les CPG sont souvent décrits isolément dans un souci de simplicité, ils interagissent en réalité avec de nombreuses structures. Bien qu'on suppose qu'il s'agisse de structures capables de générer une activité musculaire rythmique, les CPG sont encore mal caractérisés, et il est certain qu'ils ne suffisent pas à mettre en place la locomotion chez l'homme. En effet, la plupart des handicaps d'origine neurologique ont un impact sur la marche, et de nombreuses zones jouent donc un rôle important dans sa régulation. En particulier, le cortex cérébral, les noyaux gris centraux , le tronc cérébral et le cervelet contribuent à mettre en place le mouvement (fig. 5.9).

Le cortex cérébral planifie la locomotion et envoie une commande « volontaire », les noyaux gris de la base sélectionnent les patterns locomoteurs appropriés, le tronc cérébral active les central pattern generators (CPG) qui génèrent des patterns locomoteurs en activant les muscles de manière rythmique. Une fois le mouvement mis en place, les afférences sensorielles envoient un retour sur le mouvement effectué à différents acteurs du système nerveux qui prennent en compte ce retour, de manière réflexe ou non, pour moduler la marche. Le cervelet prend également en compte ces informations et interagit avec le cortex, les noyaux gris centraux, le tronc cérébral et la moelle.
Cortex
Le cortex est impliqué dans l'activation volontaire de la locomotion chez les mammifères (Grillner, 2006). Par ailleurs, pendant la marche, les corti préfrontal, sensori-moteurs, cingulaire et pariétal sont activés chez l'homme, et voient leur activité modulée en fonction de la période du cycle de marche. Toutefois, on ne sait pas clairement si le cortex est impliqué activement dans le contrôle de la locomotion à chaque cycle, ou s'il se sert des afférences sensitives pour moduler le signal descendant à partir de la MLR (Gwin, Gramann, Makeig et Ferris, 2011). Il semble tout de même que le cortex soit particulièrement actif lorsque la marche se fait en terrain irrégulier, ou chez des populations sujettes à des troubles de la marche, ce qui suggère qu'il intervient en réponse aux afférences sensitives (Zehr et Duysens, 2004). De plus, chez les chats, le cortex voit son activité modifiée avant la locomotion, mais aussi pendant la locomotion lorsqu'une perturbation requiert un guidage visuel. Il serait donc impliqué dans l'activation de la marche, puis au cours de celle-ci dans l'évaluation de la distance située entre le corps et l'obstacle, la planification de la position que devra avoir le membre pour y répondre, et l'initiation de la modification motrice qui en résulte, en coordonnant les quatre membres (Drew et Marigold, 2015).
Tronc cérébral
Comme nous l'avons mentionné, Shik et al. (1966) ont identifié qu'une zone spécifique du tronc cérébral, la région locomotrice mésencéphalique ou MLR, pouvait initier la locomotion chez le chat mésencéphalique. De plus, l'augmentation de l'intensité de la stimulation sur cette zone provoquait une augmentation de la vitesse de la locomotion, et même un passage au trot puis au galop. Par la suite, d'autres zones du tronc cérébral impliquées dans la locomotion ont été découvertes (fig. 5.10).

CTD : champ tegmental dorsal ; CTV : champ tegmental ventral ; RLM : région locomotrice mésencéphalique ; RLS : région locomotrice subthalamique.
Chez le chat, deux zones du pont (c'est-à-dire la partie centrale du tronc cérébral) ont été identifiées comme responsables du tonus postural : la dorsal tegmental field (DTF) et la ventral tegmental field (VTF). Chez un chat éveillé, la stimulation de la DTF implique une suppression du tonus des muscles extenseurs, faisant passer le chat de la station debout à la station assise puis allongée.
La stimulation de la VTF implique au contraire une augmentation du tonus des muscles extenseurs, s'accompagnant du passage à la posture debout puis d'une marche spastique. Enfin, la subthalamic locomotor region (SLR) serait impliquée dans l'initiation de la locomotion en tant que comportement à but orienté : quand elle est stimulée, le chat se lève pour marcher doucement en orientant sa tête de tous les côtés. Elle pourrait donc contribuer aux comportements de recherche, de chasse ou de défense (Mori, Sakamoto, Ohta, Takakusaki et Matsuyama, 1989).
La SLR contribue ainsi à l'activation de la locomotion. En effet, en cas de section préservant la SLR, des chats situés sur un tapis roulant peuvent marcher spontanément lorsque celui-ci est activé. En revanche, en cas de section sous la SLR, une stimulation de la MLR est nécessaire pour déclencher la locomotion. L'existence de telles zones locomotrices a été confirmée chez l'homme grâce à l'IRM fonctionnelle associée à l'imagerie mentale (Jahn et al., 2008).
Noyaux gris centraux
Les noyaux gris centraux (également appelés « ganglions de la base » ou « noyaux gris de la base ») regroupent différents noyaux situés sous le cortex, dont le striatum (qui regroupe les noyaux caudés et le putamen), le pallidum (qui regroupe les globus pallidus interne et externe), le thalamus et les noyaux sous-thalamiques . Ils semblent impliqués dans la mise en place de comportements stéréotypés tels que la marche et, en particulier, dans le choix du comportement moteur à activer. En effet, plusieurs groupes de CPG existent et peuvent être impliqués dans la locomotion, la respiration ou encore la mastication. Selon Grillner (2006), le pallidum maintient tous ces CPG en état d'inhibition active lorsqu'un mammifère se trouve à l'état de repos. L'inhibition du CPG ciblé doit donc être levée pour initier un comportement moteur. Le striatum, autre structure appartenant aux noyaux gris centraux, peut être activé directement par le cortex ou par le thalamus, et a une activité inhibitrice sur le pallidum. Ainsi, l'activité d'un CPG spécifique n'est mise en place que lorsque son inhibition est levée, ce qui est permis par l'activation d'une partie spécifique du striatum qui inhibe elle-même le pallidum. Les noyaux gris ont donc un rôle fondamental dans la détermination du CPG à activer.
Cervelet
Le cervelet, situé derrière le tronc cérébral et sous le cerveau, possède tant de connexions avec les autres structures nerveuses qu'il constitue un élément central de la régulation de la marche : il est connecté à la moelle épinière, au tronc cérébral, au vestibule, aux noyaux gris et aux corti moteur primaire, prémoteur, somato-sensoriel, pariétal, préfrontal et temporal.
Il peut ainsi recevoir des informations sensorielles lors de la marche depuis la moelle épinière et le vestibule, et moduler les faisceaux descendants impliqués dans la régulation de la locomotion.
Le cervelet contribue probablement à moduler le délai et la force de l'activité musculaire générée par les patterns locomoteurs. Il aide à coordonner les mouvements relatifs entre articulations, au sein d'un membre et entre les membres, pour peaufiner les patterns.
Il est également nécessaire pour contrôler la posture érigée. Ainsi, des troubles cérébelleux impliquent un tonus postural anormal en station assise et debout. Enfin, il est impliqué dans les mécanismes de feedback 5 et de feedforward 6 et permet ainsi de maintenir l'équilibre lors de la locomotion (Morton et Bastian, 2007). En cas de lésion du cervelet, on parle d'ataxie cérébelleuse. L'ataxie constituant un manque de coordination, la marche du patient cérébelleux est souvent appelée « marche ébrieuse », puisqu'elle rappelle la marche d'une personne en état d'ébriété. Il existe un tremblement à l'effort pouvant provoquer des titubations de la tête et du tronc.
Le patient cérébelleux est victime d'instabilité posturale l'obligeant à réduire sa longueur et sa durée de pas et à augmenter sa largeur de pas afin d'élargir son polygone de sustentation. Il souffre de troubles de l'équilibre et a un risque de chute accru. Il est également victime de troubles de la coordination entre les différents segments du membre inférieur. Les enregistrements EMG montrent des bouffées plus hautes et plus longues, ce qui pourrait constituer une tentative de compensation du manque d'équilibre, mais aussi être un effet direct de la maladie, donnant un argument supplémentaire concernant le rôle modulateur du cervelet sur les patterns locomoteurs (Martino et al., 2014).
Afférences sensorielles
Les afférences sensorielles impliquées dans la locomotion sont multiples. En effet, le corps peut avoir recours à toutes les informations disponibles pour assurer une marche adéquate et impliquer ainsi les mécanismes proprioceptifs, tactiles, visuels et vestibulaires. Les informations recueillies peuvent affecter directement la marche via des circuits réflexes spinaux, ou faire relais dans des structures supra-spinales où une intégration multisensorielle permet l'élaboration de réponses motrices adaptées. Les afférences sensorielles permettent ainsi d'obtenir un feedback sur le mouvement effectué, mais aussi de construire les circuits de feedforward, qui serviront lors d'expériences futures.
Afférences sensorielles issues des membres inférieurs
Les afférences sensorielles superficielles (c'est-à-dire tactiles) ou profondes (c'est-à-dire proprioception) issues des membres inférieurs semblent participer à la transition entre les phases du cycle de marche.
En particulier, le réflexe cutané a été objectivé chez l'adulte. Il implique notamment une réponse du muscle tibial antérieur suite à une stimulation des nerfs cutanés du pied : par exemple, une stimulation des afférences du nerf sural en fin de phase d'appui facilite l'activation du tibial antérieur. Chez des patients souffrant de lésions corticales, la stimulation de différents sites cutanés peut ainsi aider à restaurer l'activité du tibial antérieur en phase oscillante.
Selon Zehr and Duysens (2004), les CPG jouent probablement un rôle dans cette réponse.
De plus, selon Guertin (2013), les réflexes monosynaptiques Ia et les circuits réflexes impliquant des interneurones Ib joueraient également un rôle dans la locomotion en augmentant l'activité des extenseurs en phase d'appui. Enfin, d'une manière plus générale, l'état sensoriel des membres est également transmis au cervelet et à d'autres structures supra-spinales, participant ainsi à la connaissance de la position du corps dans l'espace (Morton et Bastian, 2007).
Bien qu'aucun consensus ne soit établi à leur sujet, il existerait également des réflexes induits par la résistance en charge ressentie en phase d'appui : chez les chats, lorsque la charge diminue en fin de phase d'appui, la force des extenseurs est réduite et un feedback correspondant facilite le démarrage de la phase oscillante. Toutefois, cet effet n'a été démontré que chez des chats dont les efférences cérébrales étaient réduites, et ne semble pas être prédominant chez les chats sains (Zehr et Duysens, 2004).
Chez l'homme, la capacité des nouveau-nés à effectuer des pas alternés lorsque leurs pieds sont en contact avec le sol suggère également que la diminution de la charge du corps en fin de phase d'appui ainsi qu'une augmentation de l'extension de hanche déclenchent une initiation de phase oscillante (Pang et Yang, 2000). Toutefois, chez l'adulte, des modulations de la charge corporelle en phase d'appui n'ont pas d'effet sur la durée du cycle (Stephens et Yang, 1999).
Vision
La vision participe également au contrôle de la locomotion. Lorsqu'un obstacle apparaît, le cortex pariétal, impliqué dans le traitement des informations visuelles, s'active pour planifier le mouvement (Drew et Marigold, 2015). La vision contribue ainsi à l'adaptation du mouvement locomoteur en cas d'obstacles, de changements de vitesse ou de changements de direction, et à la sélection d'une zone adéquate où placer le pied sur terrain accidenté. L'interprétation des informations visuelles est alors influencée par les expériences passées par feedforward. La vision contribue également, tout comme la sensibilité profonde, à la connaissance de la position du corps lors de la marche et au maintien de l'équilibre.
Les troubles de la vision impactent principalement la capacité à adapter la marche aux contraintes extérieures, et peuvent faire l'objet d'une rééducation visant à solliciter davantage les autres afférences sensorielles. En effet, chez les personnes aveugles, les afférences auditives, olfactives, sensitives et proprioceptives ont un rôle plus important (Patla, 1997).
Informations vestibulaires
Le vestibule, situé dans l'oreille interne, possède des récepteurs sensoriels capables de détecter la position de la tête dans l'espace, et les accélérations linéaires et angulaires de la tête. Les faisceaux vestibulo-spinaux contrôlent le tonus des muscles antigravitaires et permettent des ajustements posturaux dynamiques. Les faisceaux vestibulo-oculaires permettent la stabilisation du regard dans l'espace et l'obtention d'une image fixe sur la rétine malgré les mouvements de la tête. Enfin, les faisceaux vestibulo-corticaux participent à la connaissance de l'orientation du corps et de ses déplacements dans l'espace. Les patients souffrant d'un syndrome vestibulaire sont ainsi victimes d'une modification des patterns locomoteurs et de déviations des trajectoires pouvant provoquer des chutes.
La vitesse et la longueur de pas sont fortement réduites, et la durée de double appui est augmentée. La verticale subjective peut être altérée. La déviation de trajectoire, pouvant être observée sur quelques mètres en demandant au patient de suivre une ligne droite yeux fermés, est caractéristique de la pathologie vestibulaire et peut orienter le diagnostic (Lacour, 2009).
Principaux syndromes neurologiques et effets sur la locomotion
Outre les syndromes cérébelleux et vestibulaire brièvement abordés ci-dessus, deux grands syndromes neurologiques centraux peuvent être décrits : les syndromes pyramidal et extrapyramidal. Ces deux syndromes ont des effets distincts sur la locomotion.
Syndrome pyramidal
Le faisceau pyramidal (ou faisceau corticospinal) regroupe des axones dont les corps cellulaires appartiennent au cortex moteur, et constitue la voie descendante la plus directe entre le cortex moteur et les motoneurones issus de chaque niveau médullaire. Un faisceau pyramidal existe pour chaque hémicorps. Il existe donc deux faisceaux pyramidaux, dont les trajets sont croisés. En effet, au niveau du bulbe rachidien (c'est-à-dire la partie inférieure du tronc cérébral), 80 à 90 % des fibres de chaque faisceau se projettent vers le côté controlatéral du tronc cérébral, c'est la décussation.
Ces fibres constituent alors les faisceaux corticospinaux latéraux, controlatéraux au cortex dont ils sont issus. Dix à 20 % des fibres de chaque côté descendent directement pour constituer les faisceaux corticospinaux ventraux, ipsilatéraux à leur cortex de départ, et décussent dans la moelle épinière à chaque étage (Guertin, 2013). Ainsi, un faisceau pyramidal contrôle les muscles controlatéraux au cortex dont il est issu.
Une lésion des neurones corticospinaux peut survenir en cas d'atteinte de la moelle épinière, du tronc cérébral ou du cerveau, suite à différentes pathologies (par exemple, accident vasculaire cérébral, traumatisme crânien, lésion médullaire, processus tumoral). On parle alors de syndrome pyramidal. Ce syndrome est caractérisé par une parésie ou une paralysie, une hypertonie pyramidale (c'est-à-dire une spasticité), et une perte de la motricité volontaire et des habiletés fines. De manière secondaire, l'immobilité et l'hypotonie peuvent provoquer des rétractions musculaires.
La spasticité correspond à « une augmentation vitesse-dépendante du réflexe tonique d'étirement (hypertonie musculaire), accompagnée d'une vivacité des réflexes tendineux, liée à l'hyperexcitabilité de l'arc myotatique » (Lance, 1981). Selon Banky, Ryan, Clark, Olver et Williams (2017), les études actuelles ne permettent pas de caractériser son impact sur la marche, ni même d'affirmer qu'elle affecte la marche. En effet, la spasticité dépend de la vitesse d'étirement d'un muscle, et il ne serait pas certain que les vitesses et amplitudes mises en jeu dans la marche la déclenchent. Toutefois, il semble que son rôle soit bien identifié dans le stiff knee gait, qui implique une soudaine extension du genou en phase oscillante (Boudarham et al., 2014). En outre, la marche peut également être atteinte en cas de syndrome pyramidal pour d'autres raisons.
La faiblesse musculaire et les rétractions musculaires sont susceptibles d'affecter les réactions posturales, impliquant ainsi des troubles de l'équilibre et un risque de chute. De plus, elles peuvent empêcher les membres inférieurs d'atteindre des amplitudes musculaires suffisantes au cours du cycle de marche (le footdrop, par exemple, correspond à la manifestation d'une paralysie du tibial antérieur, induisant un frottement du pied sur le sol en phase oscillante).
Syndrome extrapyramidal
Si les voies pyramidales sont essentiellement impliquées dans le contrôle de la motricité volontaire et des habiletés fines, les voies extrapyramidales contribuent principalement au contrôle de comportements automatisés, comme la marche et la posture (Guertin, 2013). Elles regroupent des structures du système nerveux central exclues du faisceau pyramidal, telles que les noyaux gris centraux et les noyaux situés dans le tronc cérébral (Frey, 2017).
Une lésion survenant au niveau de ces structures implique un syndrome extrapyramidal, correspondant à des mouvements involontaires, des troubles de la tonicité musculaire et une perte de la motricité automatique. La maladie de Parkinson constitue la manifestation la plus fréquente de ce syndrome. Elle correspond à une dégénérescence des circuits dopaminergiques présents entre la substance noire (structure appartenant au tronc cérébral et composée de neurones dopaminergiques) et le striatum (appartenant aux noyaux gris centraux). Elle se caractérise par un ensemble de signes constituant la triade parkinsonienne : la rigidité, l'akinésie (et la bradykinésie) et les tremblements de repos (Frey, 2017). La rigidité est présente au repos et majorée à l'effort, perturbant tous les mouvements.
L'akinésie constitue une difficulté à initier les mouvements, et est associée à la bradykinésie, qui correspond à une lenteur des mouvements volontaires et implique une perte des réactions posturales. Enfin, les tremblements surviennent au repos, par opposition aux tremblements observés dans le syndrome cérébelleux, qui surviennent à l'effort.
Lors de la marche, l'ensemble des troubles décrits dans la triade parkinsonienne contribuent à augmenter le risque de chute. La rigidité perturbe tous les mouvements, et la perte des réactions posturales implique des risques de chute à chaque obstacle ou changement de direction. La marche se fait à petits pas. De plus, le patient est penché en avant, court après son centre de gravité , et a perdu le ballant des bras et la dissociation des ceintures.
Enfin, les ajustements posturaux anticipateurs permettant normalement l'initiation de la marche sont perturbés, et la personne souffrant d'une maladie de Parkinson initie elle-même le mouvement, avec difficulté, risquant là encore la chute. Même au cours de la marche, elle peut être victime de freezing , c'est-à-dire d'un arrêt soudain où l'individu n'arrive pas à redémarrer.
La rééducation de la marche a pour but d'améliorer les capacités d'équilibration, d'inciter le patient à déplacer son centre de gravité vers l'arrière, et de travailler l'initiation du pas en utilisant des indices. Ces indices peuvent être auditifs ou visuels et correspondent à un signal de départ associé à la consigne d'initiation de la marche. Ils semblent solliciter les ajustements posturaux anticipateurs davantage que la seule volonté du patient d'initier son pas (Lu, Huffmaster, Tuite, Vachon et MacKinnon, 2017).
Plasticité du système nerveux et rééducation de la marche en cas de déficience d'origine neurologique
La plasticité du système nerveux correspond à la capacité qu'ont les neurones à se réorganiser au cours de la vie, au cours d'un apprentissage ou après une lésion. En cas de mort neuronale au niveau cortical, la récupération d'une fonction est possible grâce aux mécanismes de plasticité cérébrale. En effet, après la perte de fonction d'un membre suite à des lésions cérébrales, l'utilisation intensive de ce membre orientée vers un but précis permet d'augmenter le recrutement de matière grise dans les aires corticales motrice et sensitive, et d'améliorer ainsi la fonction de ce membre (Gauthier et al., 2008).
Gauthier et al. (2008) suggèrent que les mécanismes de plasticité cérébrale ainsi stimulés permettraient une réorganisation fonctionnelle du cerveau : des zones cérébrales initialement non impliquées dans la réalisation d'une tâche pourraient former de nouvelles voies motrices permettant la réalisation de cette tâche.
Selon Carr and Shepherd (2011), après un accident vasculaire cérébral, la mobilisation précoce et l'entraînement intensif des membres atteints à des activités fonctionnelles permettent de solliciter ces mécanismes.
Par ailleurs, Isa and Nishimura (2014) ont montré, à l'aide d'études sur des singes, que la moelle épinière possédait également un potentiel de plasticité après une lésion, favorisé par l'entraînement spécifique et l'activité physique précoce.
De plus, la réorganisation neuronale survenant après une lésion médullaire intervient également au niveau du cortex moteur et des noyaux gris centraux. Il semble donc que la majorité des structures appartenant au système nerveux central ait un potentiel de plasticité pouvant être mis à profit à la suite d'une lésion grâce à une rééducation intensive et précoce, et en particulier dans le cas de la rééducation de la marche qui constitue un mouvement fonctionnel.
Si la plasticité existe également chez l'adulte sain pour permettre les mécanismes d'apprentissage, elle est bien sûr cruciale au début de la vie. En effet, au cours de sa première année de vie, l'enfant profite de ce potentiel pour se construire des schémas moteurs en interagissant avec son environnement (Teulier, Lee et Ulrich, 2015). Certaines études suggèrent même que la capacité qu'a le nouveau-né à alterner des pas ne soit que le résultat de l'entraînement effectué in utero.
En effet, en donnant des coups de pied dans le ventre de sa mère, il créerait déjà un schéma moteur de coordination en antiphase des membres inférieurs (Robinson, Kleven et Brumley, 2008).
Cette capacité d'auto-organisation permet notamment aux enfants souffrant de handicap de trouver des solutions adéquates et personnelles leur permettant d'accomplir les mêmes actes fonctionnels que des enfants sains (Teulier et al., 2015).
Ainsi, il semble primordial de profiter de ce potentiel dès le plus jeune âge pour favoriser le développement moteur d'enfants souffrant de handicap. La motricité présente dès la naissance semble suffisante pour permettre un entraînement physique précoce en vue de solliciter la plasticité du système nerveux.
En effet, si la capacité à alterner des pas en étant soutenu au-dessus d'un support tend à disparaître entre 2 et 3 mois, elle peut réapparaître dans un environnement facilitant, comme au-dessus d'un tapis roulant augmentant les afférences sensorielles.
Il a été montré qu'un entraînement à la pratique de ces pas alternés avec soutien, sur tapis roulant, chez des enfants souffrant de trisomie 21, permettait de commencer à marcher indépendamment significativement plus tôt et de préserver des bénéfices à long terme (Ulrich, Ulrich, Angulo-Kinzler et Yun, 2001 ; Angulo-Barroso, Wu et Ulrich, 2008).
Ainsi, les interventions précoces semblent aider les enfants souffrant de handicap moteur à solliciter leur potentiel de plasticité pour construire des schémas moteurs aidant au développement de la marche.
Pour aller plus loin : automaticité de la marche
Selon Clark (2015), l'automaticité peut être définie comme « la capacité du système nerveux à coordonner efficacement les mouvements, et avec une utilisation minimale de ressources de contrôle exécutif demandeuses d'attention ».
En ce sens, un processus automatique s'oppose à un processus exécutif ou contrôlé. Si la marche est souvent considérée comme une activité automatique, Clark (2015) propose que l'automaticité soit plutôt un paramètre témoignant de la qualité de la marche : « L'automaticité de la marche n'est pas simplement une vision théorique du contrôle locomoteur ; elle a des bases neurophysiologiques, peut être évaluée objectivement, et plusieurs stratégies peuvent être utilisées pour la cibler en rééducation. »
En outre, l'existence d'un lien entre la marche et la cognition semble établie : les populations souffrant de déficits cognitifs ont toujours une marche atypique et chutent davantage (Amboni, Barone et Hausdorff, 2013) ; certains soulignent même que nos mécanismes cognitifs sont ce qui nous sépare des robots, et devraient donc expliquer la différence entre leur marche et la nôtre, plus adaptable (D'Avella, Giese, Ivanenko, Schack et Flash, 2015).
Par-dessus tout, la réalisation d'une tâche cognitive concomitante à la marche implique une dégradation des paramètres spatio-temporels de la marche (Beauchet et Berrut, 2006).
L'approche méthodologique consistant en la réalisation d'une tâche cognitive en effectuant une tâche motrice est appelée « double tâche ». Cette méthode est le gold standard permettant d'évaluer l'automaticité d'une tâche (Clark, 2015 ; Seger et Spiering, 2011) : un processus totalement automatique ne devrait pas être modifié par la réalisation associée d'un processus contrôlé.
Ainsi, l'utilisation de la double tâche a permis d'établir un lien entre automaticité de la marche et risque de chute : chez la personne âgée, une dégradation de la performance en double tâche est corrélée au risque de chute.
Selon Beauchet and Berrut (2006), étudier l'effet de la double tâche cognitivo-motrice est donc important pour établir des tests cliniques prédictifs du risque de chute et pour mieux comprendre les relations entre motricité et cognition.
Chez le sujet sain, et encore davantage chez le sujet âgé ou souffrant d'un handicap neurologique, les paramètres spatio-temporels de la marche sont dégradés en double tâche, résultant principalement en une vitesse de marche réduite et une augmentation de la variabilité de durée du pas (Al-Yahya et al., 2011). L'existence d'une interférence cognitivo-motrice chez l'adulte sain montre que l'automaticité de la marche n'est que partielle.
Selon Al-Yahya et al. (2011), la marche n'est que peu perturbée face à des tâches cognitives répondant à des stimuli extérieurs, telles que des tâches de temps de réaction (c'est-à-dire des tâches où une action motrice doit suivre un stimulus extérieur le plus rapidement possible). Ce type de tâche serait contrôlé par des réseaux plus archaïques que ceux du contrôle de la marche et interférerait donc peu avec eux. Toutefois, la marche est davantage perturbée par des tâches cognitives dites « internes », telles que la génération de listes de mots ou la réalisation répétée de soustractions.
Ces tâches feraient intervenir des réseaux neuronaux complexes connectés à de nombreuses régions cérébrales, et plus susceptibles de perturber la marche par interférence.
Redondance du contrôle moteur : implication en rééducation et théorie des synergies musculaires
De nombreux éléments du contrôle de la locomotion ont été identifiés, mais au vu du nombre de structures impliquées (systèmes nerveux central et périphérique, muscles et articulations), il reste surprenant qu'un individu souhaitant marcher puisse produire une réponse motrice organisée, rapide, reproductible, modulable et économique.
Cette réflexion anime encore les scientifiques aujourd'hui et a été introduite par Bernstein (1967) sous la forme du problème des degrés de liberté.
Le « problème des degrés de liberté », ou « redondance du contrôle moteur », correspond à l'existence d'un nombre infini de moyens qu'il existe pour l'homme d'effectuer un mouvement fonctionnel.
Attraper un objet situé sur une table plus basse que l'épaule, par exemple, peut se faire de différentes manières, en baissant le bras, en fléchissant le dos ou en fléchissant les genoux, ces stratégies pouvant être mises en place ensemble et donner ainsi lieu à une multitude de trajectoires différentes.
Ce problème est, en outre, particulièrement applicable à locomotion, qui constitue un comportement moteur complexe, faisant intervenir de nombreux acteurs des systèmes nerveux et musculo-squelettique.
De nombreux éléments du corps humain sont responsables de cette redondance motrice. La réalisation d'un même mouvement fonctionnel peut se faire en mettant en jeu différentes articulations (fig. 5.11). De plus, une même articulation peut souvent être mise en mouvement par plusieurs muscles agonistes (la flexion plantaire, par exemple, peut s'effectuer grâce au soléaire, aux gastrocnémiens, ou au tibial postérieur).

Ici, saisir un verre sur une table peut s'effectuer en tendant le bras vers le bas, ou en fléchissant le tronc ou les genoux.
Enfin, un même muscle squelettique contient de multiples unités motrices (ensemble de fibres musculaires innervées par un axone) qui ne sont pas nécessairement recrutées en même temps (Bernstein, 1967).
Implication en rééducation
Ce panel particulièrement riche de solutions existantes pour effectuer un mouvement conduit notamment, en rééducation, à la notion de compensations. En effet, lorsqu'il devient impossible d'utiliser un muscle ou d'exploiter une amplitude articulaire, le corps humain peut mettre en place un autre moyen de réaliser le mouvement ciblé. En outre, la redondance du contrôle moteur est tellement importante qu'un déficit initial peut conduire à plusieurs compensations.
Dans l'exemple d'un déficit du tibial antérieur, conduisant à un frottement du pied sur le sol en phase oscillante, le raccourcissement d'un côté du corps permettant le passage du membre peut être assuré par une flexion de hanche excessive, une abduction de hanche, ou encore par une inclinaison latérale du tronc impliquant une levée de l'hémi-bassin (fig. 5.12 ; Don et al., 2007).

La redondance du contrôle moteur peut donc permettre à l'homme de gérer les perturbations ou de pallier les déficits en mettant en place des compensations. Cette capacité doit toutefois être considérée avec précaution. En effet, les mécanismes de compensations permettent d'effectuer une tâche et sont donc bénéfiques à court terme, mais peuvent, à long terme, induire des pathologies ou être trop coûteux énergétiquement pour subsister.
Ainsi, chez les personnes en situation de handicap neurologique, où les mécanismes de plasticité peuvent permettre le traitement du déficit initial, on choisit souvent de réprimer la tendance à utiliser ces compensations pour privilégier la récupération du mouvement typique.
En revanche, en cas de handicap chronique où la guérison de la déficience est improbable ou impossible, l'apprentissage de nouvelles coordinations doit être mis en place pour permettre une récupération fonctionnelle (Roby-Bramy, Hoffmann, Laffont, Combeaud et Hanneton, 2005).
Théorie des synergies musculaires
L'existence d'une multitude de moyens permettant d'effectuer une tâche motrice met en lumière la complexité à laquelle le système nerveux doit faire face pour effectuer un mouvement. Ainsi, si la redondance est utile en cas de déficit (fig. 5.12), elle a été étudiée par Bernstein (1967) sous la forme d'un problème à résoudre par le système nerveux pour mettre en place un comportement moteur efficace : c'est le problème des degrés de liberté.
Pour Bernstein (1967), il serait trop coûteux et complexe de contrôler chaque degré de liberté individuellement. L'efficience d'un mouvement ne pourrait résulter que de l'envoi d'une commande simultanée de plusieurs degrés de liberté. Ainsi, il a proposé une organisation hiérarchique du contrôle moteur, correspondant au regroupement des muscles en unités fonctionnelles, appelées synergies : le système nerveux n'activerait pas chaque muscle individuellement, mais plusieurs simultanément, sous forme de synergie motrice activée directement dans un but particulier.
Ces synergies seraient ensuite utilisées par le système nerveux comme des « blocs de construction », c'est-à-dire comme des éléments de base du contrôle moteur : le système nerveux les assemblerait d'une certaine manière pour mettre en place un comportement moteur particulier, comme la marche.
Des expériences neurobiologiques ont permis d'établir, en 1991, l'existence des synergies musculaires chez les grenouilles (Bizzi, Mussa-Ivaldi et Giszter, 1991). L'équipe de Bizzi a montré que la stimulation électrique ciblée sur certaines zones de la moelle épinière permettait d'orienter le membre postérieur des grenouilles vers un point précis de l'espace.
Ainsi, la moelle épinière serait disposée de telle manière qu'il lui suffirait de recevoir un influx pour induire à elle seule un mouvement fonctionnel, résultant de la combinaison finement dosée de plusieurs muscles, activés en même temps avec plus ou moins de force.
Les mêmes expériences n'ont pu être conduites chez l'homme. Toutefois, en utilisant des signaux EMG, des méthodes computationnelles (c'est-à-dire de traitement algébrique par ordinateur) ont permis de retrouver les synergies musculaires employées chez l'homme lors de la marche.
En effet, la marche étant un mouvement rythmique et stéréotypé, elle constitue un acte fonctionnel susceptible d'être contrôlé par un petit nombre de synergies musculaires, puisque la même commande serait envoyée à chaque pas. La méthode principalement utilisée est la factorisation matricielle non négative ou FMNN (Delis, Panzeri, Pozzo et Berret, 2014). Elle permet de factoriser le signal EMG recueilli pour chaque muscle, afin de présenter ce même signal sous forme d'activations simultanées de groupes de muscles à pondération relative (fig. 5.13). On considère donc que le signal EMG issu d'un muscle résulte de l'activation de différentes synergies musculaires au cours de chaque cycle de marche, chacune de ces synergies étant activée selon un pattern temporel spécifique.

Plusieurs études ont ainsi permis d'identifier, parmi le signal EMG issu de la marche humaine, quatre à cinq synergies musculaires (Ivanenko, Poppele et Lacquaniti, 2004 ; Lacquaniti, Ivanenko et Zago, 2012 ; Neptune, Clark et Kautz, 2009). Elles peuvent être présentées en fonction de leur moment d'apparition au sein du cycle de marche et de leurs fonctions biomécaniques (fig. 5.14).

Les flèches montrent la résultante des forces issues de chaque module sur le centre de masse ; les symboles + et − représentent respectivement un flux d'énergie positif ou négatif issu de l'activation d'un module. Source : Lacquaniti et al., 2012 . Patterned control of human locomotion. J Physiol, 10, 2189–99.
Les quatre à cinq modules retrouvés dans chaque cycle de marche auraient chacun un rôle fonctionnel, et seraient activés les uns à la suite des autres pour combiner les différentes sous-tâches fonctionnelles impliquées dans la marche, à savoir assurer une action antigravitaire, une propulsion et une avancée du membre vers l'avant (tableau 5.1). Allen and Neptune (2012) décrivent également une sixième synergie régulant l'équilibre médio-latéral et les oscillations du membre inférieur controlatéral.
Tableau 5.1
| Module | Muscles impliqués | Rôle et période d'activation |
|---|---|---|
| 1 | Vastes du quadriceps Moyen fessier Droit fémoral |
Amortissement et maintien du poids du corps en début de phase d'appui |
| 2 | Soléaire Gastrocnémiens |
Maintien du poids du corps et propulsion en fin de phase d'appui |
| 3 | Tibial antérieur Droit fémoral |
Relevé du pied en début de phase oscillante Maintien du poids du corps en début de phase d'appui |
| 4 | Ischio-jambiers | Amortissement de la jambe oscillante en préparation au posé du pied en fin de phase oscillante Stabilisation du bassin en début de phase d'appui |
| 5 | Autres : Ilio-psoas et érecteurs du rachis | Accélération de la jambe et stabilisation du bassin en fin de phase d'appui et début de phase oscillante |
Cette classification des modules en fonction de leur rôle fonctionnel montre combien l'utilisation de compensations telles que celles décrites ci-dessus (fig. 5.12) peut devenir problématique.
En effet, la redondance du contrôle moteur permet de raccourcir le membre inférieur en phase oscillante en utilisant le muscle ilio-psoas en cas de déficit du muscle tibial antérieur. Toutefois, l'organisation modulaire de la marche (fig. 5.14 et tableau 5.1) montre que le muscle ilio-psoas est déjà impliqué, en début de phase oscillante, dans l'accélération de la jambe vers l'avant et la stabilisation du bassin, en synergie avec les érecteurs du rachis.
Ainsi, l'utilisation d'une telle compensation pourrait conduire en une surexploitation du muscle ilio-psoas, ou encore à l'impossibilité pour ce muscle d'assurer l'accélération antérieure du membre inférieur. Toutefois, peu d'études traitant de l'implication de l'organisation du contrôle moteur en synergies musculaires sur la rééducation existent à ce jour, et l'impact des compensations (créant une réorganisation des synergies) n'est pas clairement défini.
Toutefois, de nombreuses études appuient l'existence des synergies musculaires, et nous pouvons suggérer que leur prise en compte en rééducation semble importante pour restaurer un contrôle de la marche peu coûteux en énergie, et simple d'utilisation pour le système nerveux.
Pour aller plus loin : origine nerveuse des synergies
Chez l'adulte, les synergies musculaires sont identifiées à partir de signaux EMG et regroupent donc l'ensemble de l'activité musculaire mise en place lors d'un mouvement. En outre, il est impossible de savoir quelle part de l'activité EMG enregistrée est issue des CPG, et quelle part est issue des structures supra-spinales ou de circuits réflexes liés aux flux de feedbacks périphériques. Ainsi, plusieurs hypothèses concernant l'influence des structures spinales et supra-spinales sur les synergies ont été établies puis répertoriées par Delis et al. (2014).
Pour aborder la classification de Delis et al. (2014), on décrit des synergies musculaires, et des patterns d'activation rythmique qui leur sont associés. Les patterns d'activation rythmique correspondent au moment et à la durée d'activation de chaque synergie au cours du cycle de marche (fig. 5.13).
Ainsi, pour certains, les synergies musculaires sont issues de structures supra-spinales, et les patterns d'activation rythmique sont issus de structures spinales (qui peuvent donc gérer de manière autonome la durée d'activation de chaque groupe de muscle au cours d'un cycle de marche) : c'est la modularité temporelle (fig. 5.15A).

Pour d'autres, des circuits réflexes de la moelle épinière permettent l'activation simultanée de plusieurs muscles (et donc d'une synergie musculaire), et les structures supra-spinales modulent l'activation de chaque synergie au cours du temps : c'est la modularité spatiale (fig. 5.15B).
Pour d'autres encore, les circuits réflexes de la moelle épinière existent à plusieurs niveaux, et permettent de générer à eux seuls l'activité d'une synergie musculaire regroupant des muscles ayant chacun un schéma d'activation temporel prédéfini. Les structures supra-spinales doivent alors activer ces circuits réflexes en appliquant une durée d'activation globale à chaque synergie : c'est la modularité spatio-temporelle (fig. 5.15C).
Enfin, le modèle space-by-time a également été proposé, et postule que la moelle épinière contiendrait des circuits réflexes permettant la mise en place de synergies, ainsi que d'autres circuits réflexes permettant de générer des influx rythmiques d'activation.
Ces différents circuits seraient combinés de différentes manières par les structures supra-spinales en fonction du mouvement à mettre en place (fig. 5.15D). Le lien entre les synergies musculaires et les CPG est donc encore mal caractérisé.
Pour Dominici et al. (2011), deux synergies existent dans les pas alternés que sont capables d'effectuer les nouveau-nés, et quatre synergies existent dans la marche adulte.
Aussi, l'addition de nouvelles synergies au cours du développement pourrait être due à un modelage des CPG, mais aussi à une augmentation de l'influence des structures supra-spinales sur les CPG. Les CPG pourraient ainsi évoluer au cours de la vie, ou bien constituer des structures archaïques étant de plus en plus influencées par les structures supra-spinales au cours du développement.
Conclusion
La marche est une activité cyclique, précise, rapide, modulable, économique et adaptable aux perturbations. Le cycle de marche, constitué des phases d'appui et d'oscillation, est extrêmement reproductible chez le sujet sain, en termes d'activation musculaire et d'évolution des amplitudes articulaires. La marche est donc une action complexe et résulte d'une régulation entre les CPG, les structures supra-spinales et les systèmes sensoriels. En cas de lésion de l'une des structures impliquées, différents syndromes peuvent être observés, notamment l'ataxie cérébelleuse, l'ataxie vestibulaire, le syndrome pyramidal et le syndrome extrapyramidal.
Chacun de ces syndromes a un effet différent sur la marche et engendre ainsi des symptômes qui lui sont spécifiques. Aussi, il est important de reconnaître les principaux signes associés aux handicaps d'origine neurologique afin d'orienter le plus rapidement possible les patients susceptibles d'en souffrir.
Par ailleurs, si les rôles de plusieurs structures ont été objectivés, de nombreux mécanismes liés au contrôle de la marche sont encore mal connus. Le problème des degrés de liberté a, notamment, interpellé la communauté scientifique, et des synergies musculaires ayant chacune un rôle fonctionnel au cours du cycle de marche ont été identifiées, mais leur origine nerveuse et leur lien avec les CPG sont encore mal connus.
La redondance du contrôle moteur constitue également une richesse extraordinaire pour le corps humain, en permettant la mise en place de compensations s'il existe un handicap. Aussi, en cas de handicap chronique dont le potentiel de récupération est faible, ces compensations doivent être mises à profit pour créer de nouvelles synergies motrices. En revanche, dans certains cas, la mise en place de compensations doit être empêchée, de manière à stimuler la plasticité du système nerveux . En effet, après une lésion neurologique, une rééducation précoce, intensive et fonctionnelle permet de stimuler la plasticité du système nerveux et de restaurer la commande motrice, évitant ainsi le recours aux compensations, qui peuvent être coûteuses en énergie.
