Chapitre 16: Syndromes vestibulaires
« Qu’est-ce qui force l’homme à ouvrir les yeux sinon le besoin de vertige ? »
Raymond Abellio
Réflexe vestibulo-oculomoteur (RVO) et stratégie substitutive saccadique précoce
Généralités
Latence du RVO
Gain du RVO canalaire
Voies du RVO
Le premier neurone du RVO, ou neurone primaire ou neurone vestibulaire
Généralités

A. Afférentation des cellules ciliées par les neurones primaires du RVO. B. Les différents nerfs constituant le nerf vestibulaire. C. Le nerf vestibulaire dans son ensemble, depuis les organes sensoriels périphériques jusqu’aux noyaux vestibulaires.
Pathologies associées au neurone primaire
Neuronite vestibulaire
Schwannome vestibulaire

Fracture du rocher
Boucle vasculaire

Pathologies inflammatoires démyélinisantes
Noyaux vestibulaires
Généralités
- • Les noyaux vestibulaires latéraux ne reçoivent pas d’afférence vestibulaire.
- • Les supérieurs sont le siège d’afférences canalaires, majoritairement des canaux verticaux.
- • Les médians sont le siège d’afférences canalaires, majoritairement des canaux horizontaux, et utriculaires.
- • Les inférieurs sont le siège d’afférences canalaires et maculaires, utriculaires comme sacculaires.

Pathologies associées aux noyaux vestibulaires
Deuxième neurone du RVO ou neurone secondaire
Généralités
Pathologies associées au neurone secondaire
Troisième neurone du RVO ou neurone tertiaire
Généralités
Pathologies associées au neurone tertiaire


Voies vestibulocérébelleuses

ND : noyaux dentelés ; NF : noyaux fastigiaux ; NO : nodulus ; Fl : floculus ; IV vent. : IVe ventricule.
Voies secondaires du RVO

A. Voie horizontale. B. Voie verticale.
Codage du RVO
Cellules ciliées
Cellules ciliées de type II ou toniques

Cellules ciliées de type I ou phasiques
- • aux basses et moyennes vitesses de mouvements de la tête, le codage canalaire est bidirectionnel ; les mouvements des yeux que l’on observe (phases lentes des nystagmus) sont donc générés par les systèmes canalaires des deux labyrinthes selon le principe push-pull excitation-inhibition. Le gain normal du RVO se situe entre 0,4 et 0,8 ;
- • aux hautes vitesses de mouvements de tête, ce codage est unidirectionnel ; ces mêmes phases lentes sont alors générées par le système canalaire d’un seul labyrinthe ; pour les mouvements horizontaux, il s’agit du labyrinthe placé du côté du sens du mouvement. La commande effectrice est rapide car nécessitant peu d’intégration centrale ; le gain du RVO est voisin de 1 chez le sujet sain.
Pathologies associées à la cellule ciliée ou sa synapse
- • L’hydrops endolymphatique, responsable de la maladie de Menière, affecte les cellules ciliées, initialement les cellules toniques (type II) ; plus tardivement au cours de la maladie, les cellules phasiques (type I) peuvent aussi être atteintes. On observe donc précocement un déficit aux examens caloriques alors que les gains du VHIT restent longtemps normaux.
- • Les atteintes ototoxiques sont rencontrées lors d’expositions des cellules ciliées à de nombreuses molécules ; la plus couramment observée implique les antibiotiques de la famille des aminosides, particulièrement la gentamicine. La sensibilité interindividuelle est variable ; la destruction est rarement totale, mais affecte souvent profondément les fonctions d’équilibration.
- • Il existe aussi des maladies auto-immunes de l’oreille interne, dont les symptômes peuvent mimer la maladie de Menière avec ses quatre signes cliniques, hypoacousie, vertige, acouphène, plénitude d’oreille. Le syndrome de Cogan associe une kératite aux signes cochléovestibulaires.
- • Parmi les maladies génétiques, on citera le syndrome d’Usher type 1 qui associe une perte de l’équilibre à une perte progressive de l’audition et de la vision (vision en tunnel) par rétinite pigmentaire.
Efférences du RVO
Muscles effecteurs
- • les muscles droits médiaux et droits latéraux commandent les mouvements oculaires horizontaux, respectivement l’adduction et l’abduction ; ils sont respectivement sous la commande des noyaux occulomoteurs (III) et abducens (VI) qui reçoivent les signaux codés par les canaux semi-circulaires horizontaux ;
- • les muscles droits supérieurs et droits inférieurs commandent les mouvements oculaires verticaux, respectivement l’élévation et l’abaissement ; ils sont sous la commande des noyaux oculomoteurs (III) ;
- • les muscles obliques supérieurs et obliques inférieurs commandent les mouvements oculaires de cyclotorsion, respectivement l’incyclotorsion et l’excyclotorsion ; ils sont aussi accessoirement et respectivement abaisseur et élévateur de l’œil. Ils sont sous la commande respectivement du noyau trochléaire (IV) et du noyau oculomoteur (III).
Exploration du RVO
Instrumentation
- • Les lunettes de Frenzel (1950) ont longtemps servi à l’observation des nystagmus. Deux lentilles grossissantes (20 dioptries) permettent à l’observateur de visionner les yeux grossis et éclairés du patient dont la fixation est abolie par le floutage [9].
- • La vidéonystagmoscopie puis la vidéonystagmographie (E. Ulmer) sont aujourd’hui les instruments les plus utilisés dans l’analyse des nystagmus : une caméra filme l’œil (ou les deux yeux) en lumière infrarouge à l’intérieur d’un masque étanche à la lumière extérieure.
Nystagmus spontané
Recherche d’un nystagmus positionnel ou de position

Épreuves cinétiques au fauteuil rotatoire
Épreuves sinusoïdales
Épreuves dites en step test
Épreuves caloriques
Head Shaking Test (HST)
- • réponse normale à l’examen : absence de nystagmus (symétrie des voies vestibulo-oculaires) ;
- • réponse anormale à l’examen : présence de nystagmus horizontaux droits ou gauches traduisant une asymétrie de la fonction canalaire et/ou du velocity storage.
Test vibratoire osseux vestibulaire (TVOV) de Dumas
Head Impulse Test (HIT) et Video Head Impulse Test (VHIT)
Acuité visuelle dynamique (AVD)
Stratégie substitutive saccadique précoce (un remède contre l’oscillopsie)

A. Gauche. B. Droite.
Vertige positionnel paroxystique bénin
Introduction
Étiologie
Physiopathogénie
Diagnostic et traitements des différentes formes de VPPB
Diagnostic
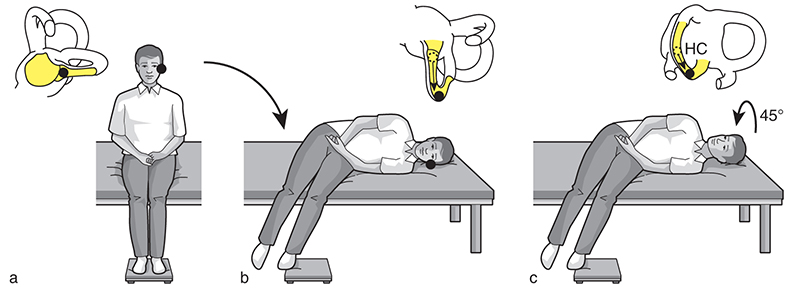
Pour le VPPB du canal postérieur

Figure de gauche : La tête est préalablement tournée à droite dans le plan du canal postérieur droit, on recherche un nystagmus torsionnel anti-horaire à composante vertical supérieur.
Figure de droite : La tête est préalablement tournée à gauche dans le plan du canal postérieur gauche, on recherche un nystagmus torsionnel horaire à composante vertical supérieur. © : Carole Fumat
Pour le canal latéral

1 : La tête est positionnée nez au zénith on recherche un nystagmus horizontal droit ou gauche.
2 : La tête est tournée à droite on recherche un nystagmus horizontal droit dans le cas d’un VPPB horizontal géotropique ou un nystagmus gauche dans le cadre d’un VPPB horizontal agéotropique.
3 : La tête est tournée à gauche on recherche un nystagmus horizontal gauche dans le cas d’un VPPB horizontal géotropique ou un nystagmus droit dans le cadre d’un VPPB horizontal agéotropique. © : Carole Fumat
Diagnostics différentiels
Quelques pathologies périphériques qui peuvent mimer un VPPB
- • la fistule périlymphatique. La fuite de liquide endolymphatique lors de la mise en position basse de la tête par une lésion au niveau d’une fenêtre (généralement post-traumatique) ;
- • la maladie de Menière : l’augmentation de pression dans le labyrinthe membraneux lors de la mise en décubitus peut révéler un nystagmus latent qui peut s’inverser au retour à l’orthostatisme ;
- • le syndrome de Minor ou déhiscence du canal antérieur, qui provoque aussi des modifications de pression dans le CSC ;
- • le conflit artère/nerf lors de la rotation de la tête, qui met en contact le nerf vestibulaire et l’artère cébelleuse antéro-inférieure (AICA). Au fil du temps, la protection myélinique du nerf s’altère et le contact génère des stimulus nerveux le long du nerf provoquant des décharges nystagmiques ;
- • l’intoxication alcoolique responsable de la « cupule lourde » ; la cupule baignant dans un liquide chargé d’alcool modifiant la densité de l’endolymphe devient un véritable capteur de gravité.
Quelques pathologies centrales qui peuvent mimer un VPPB
Traitement du VPPB du canal postérieur
Manœuvre libératrice

Manœuvre de repositionnement des otolithes d’Epley

Traitement du VPPB du canal horizontal
Manœuvre de Gufoni pour la forme géotropique

Manœuvre de Gufoni pour la forme agéotropique
Syndrome vestibulaire périphérique unilatéral
Généralités

Névrite du nerf vestibulaire supérieur

- • un nystagmus spontané battant vers le côté sain, qui est visible avec fixation oculaire dans la phase précoce post-crise, puis sous masque de vidéonystagmoscopie plus tardivement lorsque la compensation du déficit aura permis d’inhiber le nystagmus spontané par la fixation oculaire ;
- • une prépondérance directionnelle nystagmique du côté sain aux tests cinétiques basses et moyennes vitesses [47] ;
- • une déviation posturale vers le côté atteint lors des tests de Romberg, du piétinement de Fukuda Unterberger, de la marche en étoile, montrant un syndrome harmonieux [6] ;
- • des déficits sur les fonctions canalaires phasiques horizontale et verticale antérieure au VHIT (figure 16.20) ;
- • un déficit aux épreuves caloriques calibrées [25] ;
- • des potentiels évoqués otolithiques myogéniques (PEOM) utriculaires (oVEMP pour ocular vestibular evoked myogenic potential) déficitaires, les potentiels sacculaires (cVEMP pour cervical vestibular evoked myogenic potential) restant habituellement normaux [48] ;
- • la nature des troubles du contrôle postural sur plateforme de forces statique ou dynamique ; on évaluera les déviations posturales comme le poids des entrées sensorielles visuelle, vestibulaire, proprioceptive [49, 50].

- 1. réaliser une prise en charge rééducative comportementale en privilégiant un travail actif ;
- 2. débuter la rééducation le plus précocement possible ; c’est au cours du premier mois post-lésionnel que se configure au mieux la plasticité centrale ;
- 3. connaître le véritable rôle de la rééducation vestibulaire ; savoir donc adapter la rééducation en fonction des capacités compensatrices du patient et du délai post-lésionnel, de la nature de la lésion incriminée ;
- 4. favoriser les processus d’adaptation plutôt que d’habituation ;
- 5. éviter tout protocole stéréotypé ; repérer en particulier les mauvaises stratégies adaptatives mises en place par le patient comme l’occlusion palpébrale plutôt que la stratégie saccadique précoce, la sous-utilisation de l’entrée proprioceptive cervicale pourtant si importante dans les processus de compensation ;
- 6. prendre en compte le profil sensoriel, moteur et cognitif du patient ; ne pas hésiter à utiliser pour cela des échelles d’évaluation des capacités proprioceptives, haptiques, émotionnelles, cognitives perceptives, etc. ;
- 7. savoir évaluer la progression de la thérapie et donc pouvoir remettre en question sa validité tout en recherchant les causes d’un défaut de progression ;
- 8. savoir prendre en compte anxiété et stress qui sont souvent la cause d’un défaut de compensation ;
- 9. favoriser une rééducation dans un contexte écologique ; pour cela, la réalité virtuelle peut être contributive, de même que le travail en double tâche ;
- 10. savoir motiver son patient ; donc favoriser les exercices ludiques comme écologiques.
Névrite du nerf vestibulaire dans son ensemble

Névrite du nerf vestibulaire inférieur


Névrite du nerf ampullaire
Labyrinthite aiguë
Forme aiguë du schwannome vestibulaire
Accident thrombo-embolique ou hémorragique labyrinthique
Aréflexie vestibulaire bilatérale
Étiologie (tableau 16.1)
Tableau 16.1
| Type étiologique (Prévalence si connue) |
Éléments étiologiques |
|---|---|
Idiopathique (51 %) |
Non adapté |
Toxique/métabolique (13-21 %) |
Antibiotique Furosémide Cisplatine Aspirine Alcool Carence en vitamine B12 Déficience en folate Hypothyroïdisme Empoisonnement au styrène Association AINS/pénicilline |
Infectieuse (3,8-12 %) |
Méningite Encéphalite Cérébellite Maladie de Behçet Borréliose Infection herpétique Névrite bilatérale |
Auto-immune (10 %) |
Syndrome de Cogan Syndrome de Susac Sarcoïdose Granulomatose de Wegener Syndrome de Gougerot-Sjögren Colite Maladie cœliaque Polyarthrite noueuse Syndrome des antiphospholipides Autres maladies systémiques |
| Neurodégénérative | CANVAS (cerebellar ataxia, neuropathy, vestibular areflexia syndrome). Il s’agit d’une ataxie cérébelleuse accompagnée d’une neuropathie sensitive et d’une aréflexie vestibulaire bilatérale Ataxie épisodique Sidérose superficielle Atrophie multisystématisée Polyneuropathies SCA3 (SCA : ataxie spinocérébelleuse) SCA6 (SCA : ataxie spinocérébelleuse) Neuropathies sensorielles dysautonomiques héréditaires type IV Autres ataxies |
| Génétique | DFNA-9 DFNA-11 DFNA-15 DFNB-4 Mutation des chromosomes 5q, 6q, 11q, 22q |
| Vasculaire | Lésion supra- et/ou infratentorielle Dolichoectasies artérielles intracrâniennes |
| Néoplasique | Schwannomes bilatéraux Neurofibromatose de type 2 Métastases Tumeurs malignes |
| Traumatique | Traumatisme crânien, iatrogène (double implantation cochléaire) |
| Autre pathologie de l’oreille interne | Maladie de Ménière bilatérale Labyrinthite bilatérale Otospongiose bilatérale Choléstéatomes bilatéraux |
| Congénital/syndromique | Syndrome CHARGE (malformations cardiaques, atrésie choanale, retard de croissance et/ou retard mental, hypoplasie génitale, anomalies des oreilles et/ou surdité) Syndrome d’Usher Syndrome de Turner Syndrome d’Alport Dilatation de l’aqueduc du vestibule |
| Autres | Presbyvestibulie, atélectasie du vestibule |
Physiopathologie
- • la stabilisation de la scène visuelle lors des mouvements de tête ;
- • le maintien de l’équilibre dans la marche sans l’aide la vision ;
- • les tâches de navigation.
Diagnostic

Bilans
Rééducation

- • soit en mobilisant le décor tout en laissant le support stable ;
- • soit en mobilisant le support tout en laissant le décor stable.
Syndromes vestibulaires centraux
Introduction
Étiologie
Dans les pathologies chroniques
Séquelles de traumatismes crâniens
Tumeurs
Affections malformatives
Sclérose en plaques
Dans les pathologies aiguës (tableau 16.2)
Tableau 16.2
| Latéralité | Localisation | Signes neurologiques |
|---|---|---|
| Controlatéral | Faisceau spinothalamique | Hypoesthésie thermo-algique |
| Ipsilatéral | Hypoesthésie de l’hémiface Ataxie des membres Hypoesthésie tactile et proprioceptive Vertige avec nystagmus, nausée et vomissement Syndrome de Claude Bernard-Horner Dysphagie, dysarthrie, dysphonie, dyspnée si bilatéral, hoquet Tachycardie, dilatation gastrique Pseudo-asthme, dyspnée Troubles du rythme respiratoire et cardiaque Céphalées cervicales supérieures |
|
| Noyau et tractus du trijumeau | Hypoesthésie de l’hémiface | |
| Pédoncules cérébelleux inférieurs | Ataxie des membres | |
| Colonne dorsale sous décussation | Hypoesthésie tactile et proprioceptive | |
| Noyau du VIII | Vertige avec nystagmus, nausée et vomissement | |
| Fibres sympathiques de la formation réticulée | Syndrome de Claude Bernard-Horner | |
| Noyau ambigu du IX et du X | Dysphagie, dysarthrie, dysphonie, dyspnée si bilatéral, hoquet | |
| Noyau ambigu et zone adjacente | Tachycardie, dilatation gastrique | |
| Noyau dorsal du vague | Pseudo-asthme, dyspnée | |
| Faisceau solitaire | Troubles du rythme respiratoire et cardiaque | |
| Irritation artérielle | Céphalées cervicales supérieures |

Rééducation
Syndrome persistant postural perceptif (persistant postural-perceptual diziness [PPPD])
Définition
Critères de diagnostic
- • un ou plusieurs symptômes d’ébriété, ou d’instabilité ou de vertige non rotatoire présents la plupart des jours pendant au moins 3 mois. Les sensations durent longtemps, et peuvent varier en intensité. Il peut y avoir des absences de signes pendant la journée ;
- • les symptômes se présentent sans provocation spécifique, mais sont majorés par :
- – la station debout ;
- – des mouvements actifs ou passifs quelle que soit la direction ;
- – un environnement visuel mouvant ou des schémas visuels complexes.
- • les symptômes débutent généralement après un événement déclenchant : VPPB, une crise de vertige rotatoire (syndrome vestibulaire aigu) épisodique ou chronique (maladie de Ménière, migraine vestibulaire), crise d’instabilité, maladie neurologique ou médicale, attaque de panique, commotion cérébrale, entorse cervicale. Le facteur déclenchant peut parfaitement disparaître, mais le PPPD va néanmoins persister et même s’aggraver avec le temps ;
- • les symptômes déclenchent une détresse psychologique et une gêne fonctionnelle marquée ;
- • les symptômes ne sont attribuables à aucune autre maladie.
Comment peut-on expliquer le PPPD ?

Bilans
- • le test de marche de 2 minutes ;
- • le motion sensitivity quotient/test [96] ;
- • le Dizziness Handicap Inventory [97] ;
- • le questionnaire d’anxiété générale de Spielberger ;
- • une échelle analogique (0-10) sur l’ébriété, l’instabilité ressentie ;
- • le Niigata PPPD questionnaire [98], qui permet de quantifier la sévérité du syndrome.
Rééducation
Autres traitements adjuvants
Cinétoses
Définition
- • facteurs liés au stimulus (type de mouvement, fréquence, amplitude, direction, durée du stimulus) ;
- • facteurs liés à la personne (accoutumance, sensibilité, différences individuelles, comportements protecteurs, posture, administration de médicaments contre le mal des transports).
- • nausées, vomissements, inconfort gastrique, conscience épigastrique ;
- • pâleur ;
- • sueurs froides ;
- • salivation excessive ;
- • somnolence ;
- • maux de tête ;
- • étourdissements.
- • facteurs psychiques : anxiété, fatigue ;
- • facteurs environnementaux : odeurs, chaleur/froid, confinement, bruits.
- • maladie franche ;
- • malaise grave ;
- • malaise modéré ;
- • malaise léger.
Traitement rééducatif
- • répétition des stimuli ;
- • intensité graduée des stimuli ;
- • motivation du patient.

- • réduction des mouvements de tête ;
- • alignement de la tête et du corps avec l’axe de gravité ;
- • exercices respiratoires ;
- • position de décubitus dorsal.
 Focus
Focus