Chapitre 1 Moyens et objectifs de l’anatomie pathologique en médecine
 Savoir préciser la place de l’anatomie pathologique dans la démarche médicale.
Savoir préciser la place de l’anatomie pathologique dans la démarche médicale.
 Connaître et savoir donner des exemples des différents types de prélèvements cytologiques.
Connaître et savoir donner des exemples des différents types de prélèvements cytologiques.
 Connaître et savoir donner des exemples des différents types de prélèvements tissulaires.
Connaître et savoir donner des exemples des différents types de prélèvements tissulaires.
 Connaître les différentes étapes techniques qui vont permettre l’analyse microscopique d’un prélèvement cellulaire.
Connaître les différentes étapes techniques qui vont permettre l’analyse microscopique d’un prélèvement cellulaire.
 Connaître les différentes étapes techniques qui vont permettre l’analyse microscopique d’un prélèvement tissulaire.
Connaître les différentes étapes techniques qui vont permettre l’analyse microscopique d’un prélèvement tissulaire.
 Connaître les principes de la fixation cellulaire/tissulaire.
Connaître les principes de la fixation cellulaire/tissulaire.
 Connaître les principes (apports et limites) d’un examen cytopathologique.
Connaître les principes (apports et limites) d’un examen cytopathologique.
 Connaître les principes (apports et limites) d’un examen extemporané.
Connaître les principes (apports et limites) d’un examen extemporané.
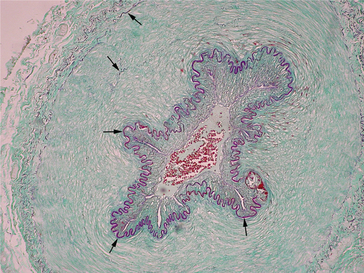
Historique
Malgré des progrès isolés et significatifs depuis la Renaissance, la médecine restait au XVIIIe siècle en France ainsi que dans de nombreux autres pays européens, tributaire de croyances périmées et de systèmes sociaux peu propices au progrès des connaissances médicales. La médecine, jadis réservée aux clercs, continuait à être enseignée à l’université alors que la chirurgie en avait été écartée pendant des siècles par une faculté de médecine intransigeante.
En 1799, publication du Traité des membranes par Bichat.
Ce traité qui constitua l’ouvrage fondamental de l’anatomopathologie initia une nouvelle façon de voir l’anatomie. En effet, à côté d’une vision montrant des organes voisins les uns des autres, il proposait une conception de l’homme constitué d’enveloppes successives autour des différents organes. Ce modèle se révéla étonnamment utile et permit de prédire de façon satisfaisante l’évolution d’un certain nombre de maladies, telles que des pathologies couramment observées à l’époque, comme la tuberculose. On observait alors très fréquemment des lésions des séreuses pleurales, péritonéales et péricardiques.
En 1819, publication du Traité de l’auscultation médiate par Laennec.
Il s’agissait d’une auscultation au moyen d’un cylindre, précurseur du stéthoscope.
Ces nouvelles méthodes donnèrent des résultats objectifs et fiables pour l’examen des organes internes. Cet ouvrage consacré en principe à la présentation et à la promotion de ce nouvel outil diagnostique comportait une partie très importante dédiée à l’examen post-mortem et à la pathologie macroscopique des tissus. Le lien entre l’auscultation et la percussion d’une part et les autopsies d’autre part était très étroit. En effet, ces nouvelles méthodes d’examen ne trouvaient leur valeur que dans une corrélation étroite avec les autopsies. Tout ceci aboutit vers les années 1830 à la constitution d’un ensemble de connaissances qui se trouva alors brutalement confronté à un nouvel instrument : le microscope. L’histoire de l’anatomie pathologique est exposée au musée Dupuytren (Paris).
Place de l’anatomie pathologique en médecine
Démarche diagnostique
L’anatomie pathologique (ou pathologie) est une discipline médicale qui étudie les lésions provoquées par les maladies, ou associées à celles-ci, sur les organes, tissus ou cellules, en utilisant des techniques principalement fondées sur la morphologie macroscopique et microscopique.
Les lésions sont des altérations morphologiques des organes, décelables par tout moyen d’observation. Celles-ci sont des signes de maladies, au même titre que les symptômes cliniques. Elles peuvent être le résultat de l’agression qui a déclenché la maladie, ou celui des réactions apparues au cours du déroulement du processus morbide. La lésion élémentaire correspond à l’altération morphologique d’une structure analysée isolément. L’association de différentes lésions élémentaires constitue un ensemble lésionnel.
Il n’y a pas forcément de corrélation étroite entre l’importance d’une lésion et son expression clinique ou biologique. Les causes des lésions sont variées : anomalies génétiques constitutionnelles ou acquises, agents infectieux (bactéries, virus, parasites, champignons, prions), agents chimiques (toxiques, caustiques, médicaments), agents physiques (agression thermique, radiations, modifications de pression atmosphérique, traumatismes), déséquilibres circulatoires, nutritionnels ou hormonaux, troubles immunitaires innés ou acquis et sénescence.
La démarche de l’anatomie pathologique est fondée sur une analyse sémiologique qui compare les tissus normaux et les tissus pathologiques. Les lésions sont confrontées aux données cliniques, biologiques et d’imagerie : c’est la corrélation anatomoclinique qui est indispensable pour permettre une interprétation synthétique qui aboutit à un diagnostic (certain, probable ou incertain).
Buts de l’anatomie pathologique dans la pratique médicale
Le rôle de l’anatomocytopathologie est de contribuer à :
• élaborer le diagnostic par la démarche anatomoclinique : les lésions sont analysées et décrites dans un compte-rendu, puis l’anatomopathologiste doit intégrer l’ensemble des faits morphologiques et des renseignements cliniques pour, en conclusion du compte-rendu, affirmer un diagnostic ou proposer une hypothèse diagnostique ;
• préciser le pronostic en apportant des éléments utiles, en particulier dans le domaine de la pathologie tumorale ;
• évaluer l’effet des thérapeutiques : les examens anatomocytopathologiques sont renouvelés au cours d’un traitement afin de juger de la disparition, de la persistance ou de l’aggravation des lésions.
Différents types de prélèvements
Prélèvements cytologiques
Les cellules isolées, ou les petits amas cellulaires, peuvent être obtenus de diverses façons :
• recueil des liquides spontanément émis (urine, expectoration, fistule, drain) ;
• raclage, brossage, écouvillonnage, aspiration de cellules desquamant spontanément (col utérin, bulle cutanéo-muqueuse, bronches, voies biliaires, aspiration après lavage bronchoalvéolaire) ;
• ponction à l’aiguille d’un liquide (épanchement de séreuse ou articulaire, liquide céphalo-rachidien, kyste, collection) avec ou sans contrôle écho-ou scannographique ;
• ponction à l’aiguille d’un organe ou d’une tumeur (ganglion, nodule thyroïdien ou mammaire) avec ou sans contrôle échographique ou scannographique ;
• apposition d’un tissu (pièce opératoire, biopsie) sur une lame.
Prélèvements tissulaires
Ils sont effectués selon trois modalités : la biopsie, les pièces opératoires et l’autopsie.
Biopsie
La biopsie consiste à prélever un fragment de tissu sur un être vivant en vue d’un examen anatomopathologique. Par extension, ce terme peut désigner le fragment tissulaire.
La biopsie peut être effectuée selon plusieurs modalités :
• par ponction à l’aide d’une aiguille coupante ou d’un trocart (foie, rein, os, etc.) : on obtient des cylindres de tissu de quelques millimètres à quelques centimètres de long (figure 1.1). Les ponctions sont effectuées « à l’aveugle » lorsque l’ensemble de l’organe est malade, ou sous repérage (échographie, scanner) lorsque la ponction doit être dirigée sur une lésion focale visible en imagerie ;
• par biopsie chirurgicale après anesthésie locale ou générale et sous contrôle de la vue : biopsie partielle, ou biopsie exérèse enlevant la totalité de la lésion ;
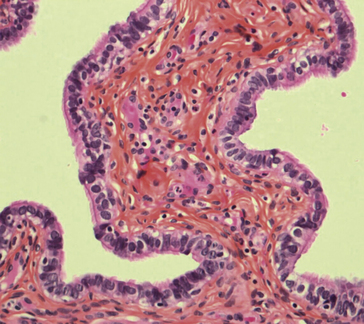
• au cours d’une endoscopie (pince montée sur l’endoscope) : fragments de 0,5 mm à 2 mm (figure 1.2).
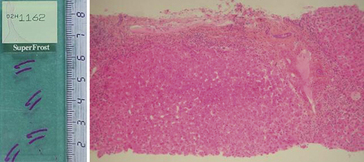
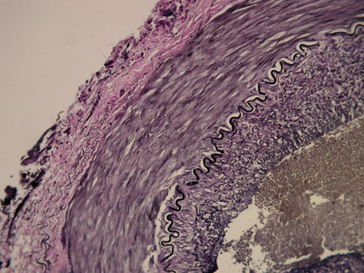
Figure 1.1 Carotte de ponction-biopsie hépatique. À gauche, vue macroscopique de la lame : deux carottes de 1 cm. À droite, vue microscopique d’une carotte colorée (* 50).
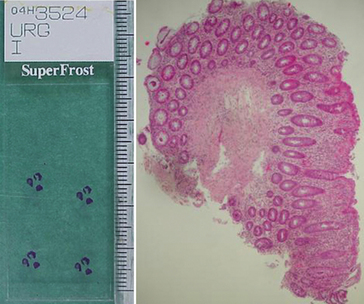
Figure 1.2 Biopsie de muqueuse colique prélevée à la pince lors d’une endoscopie. À gauche, vue macroscopique de la lame : elle présente 3 biopsies de 1 à 2 mm de diamètre, sur quatre coupes. À droite, vue microscopique d’une biopsie colorée (* 50).
La valeur des biopsies repose sur :
1. leur taille (ex : pour la recherche d’une artérite de Horton où les lésions sont segmentaires, une biopsie d’artère temporale représentative doit mesurer au moins 1,5 cm) ;
2. leur nombre : plus elles sont nombreuses, plus on a de chance de trouver du tissu tumoral, de rendre compte de l’hétérogénéité d’une tumeur et d’observer une lésion focale, mais importante pour le diagnostic ;
3. le choix de la zone biopsiée : éviter les zones nécrotiques ou hémorragiques ; sur la peau ou une muqueuse, éviter les prélèvements trop superficiels ; biopsier le ganglion ayant fait l’objet d’une ponction cytologique motivant la biopsie ;
4. la bonne préservation des tissus : ne pas étirer ou écraser les fragments, éviter le bistouri électrique « grillant » les tissus ;
5. le repérage topographique de biopsies multiples (flacons différents répertoriés).
Pièces opératoires
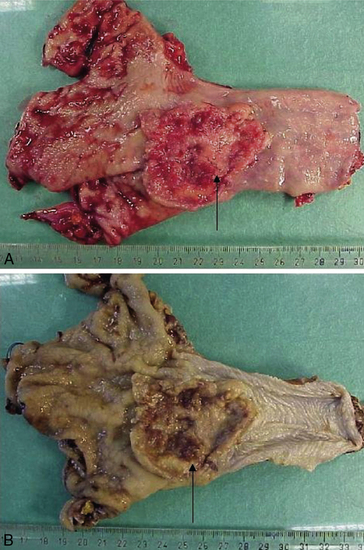
Les pièces opératoires : exérèse partielle ou complète d’un ou de plusieurs organes, séparés ou en monobloc (figure 1.3).
Autopsie
L’autopsie (ou nécropsie) correspond à un examen anatomopathologique pratiqué sur un cadavre.
Les autopsies médico-légales sont pratiquées sur ordre de la justice (réquisition du procureur, ou ordonnance d’un juge d’instruction) dans tous les cas de mort suspecte, notamment lorsqu’il n’y a pas eu de délivrance de permis d’inhumer.
Les autopsies à but scientifique sont pratiqu jour à l’hôpital, éventuellement à la demande d’un médecin traitant pour un patient décédé à son domicile.
N.B. : les autopsies médicales sont distinctes des dissections anatomiques pratiquées dans les laboratoires d’anatomie des facultés de médecine. Celles-ci sont pratiquées dans le cadre de l’enseignement de l’anatomie et pour la recherche, sur des cadavres qui sont des « dons de corps à la science ».
Techniques d’étude morphologique des prélèvements cellulaires et tissulaires
La qualité des prélèvements conditionne la qualité de l’étude anatomopathologique. Le médecin préleveur et prescripteur a une responsabilité dans l’acte anatomopathologique en s’assurant de la bonne réalisation technique du prélèvement et de son acheminement dans de bonnes conditions au laboratoire (dans des délais brefs, en respectant les règles de fixation, accompagné d’une demande d’examen correctement renseignée).
Enregistrement
Lorsqu’un prélèvement parvient au laboratoire, il est enregistré et reçoit un numéro d’identification unique. Celui-ci sera retranscrit sur les blocs et les lames, qui seront examinées au microscope après le traitement technique du prélèvement. Chaque prélèvement doit être accompagné d’une fiche de renseignements remplie par le médecin prescripteur qui doit mentionner :
1. l’identité du patient : nom, prénom(s), date de naissance, sexe ;
2. le siège, la date (jour et heure) et la nature du prélèvement (biopsie ou exérèse) ;
3. les circonstances cliniques et paracliniques qui ont motivé le prélèvement et éventuellement les hypothèses diagnostiques ;
4. l’aspect macroscopique ou endoscopique des lésions (un compte-rendu opératoire peut être utilement joint), éventuellement l’aspect d’imagerie, en particulier pour les tumeurs osseuses ;
5. les antécédents pathologiques du patient, en particulier, dans la mesure du possible, les antécédents d’examens anatomopathologiques effectués dans un autre laboratoire et la nature des traitements éventuellement administrés au malade ;
6. les nom et coordonnées du médecin prescripteur et du préleveur, et éventuellement ceux des autres médecins correspondants.
Techniques d’étude des cellules
Étalement des cellules sur des lames de verre
L’étalement est fait par le préleveur lors des cytoponctions d’organes, des frottis, écouvillonnage, brossages ou appositions. Ce geste simple doit être bien maîtrisé pour éviter un écrasement des cellules, ou des amas, en plusieurs couches peu interprétables (figure 1.4).
Cytocentrifugation sur lame de verre
Le liquide (naturel, ou d’épanchement, ou de lavage) est acheminé au laboratoire où il est centrifugé directement sur une lame de verre, sous forme de pastille (figure 1.5).
Fixation des étalements
Elle se fait soit par simple séchage à l’air pour la coloration de May-Grünwald-Giemsa (figure 1.6), soit par immersion dans l’alcool-éther, ou par application d’un aérosol de laque fixante pour les colorations de Harris-Schorr, ou de Papanicolaou (frottis cervico-utérins notamment [figure 1.7]).
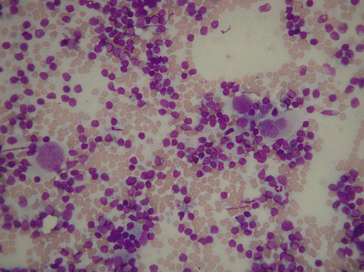
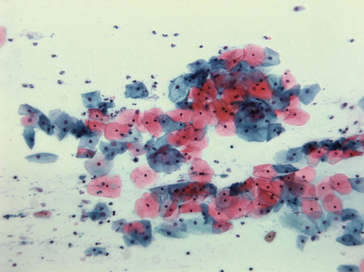
Figure 1.6 Produit de cytoponction d’un ganglion lymphatique de lymphome de Hodgkin ; étalement coloré au May-Grünwald-Giemsa.
Afin d’éviter l’altération des cellules par autolyse, la fixation, la cytocentrifugation et la coloration doivent être effectuées rapidement après l’obtention du prélèvement :
• fixation des frottis cervico-utérins par le médecin préleveur ;
• acheminement rapide d’un liquide à l’état frais au laboratoire ;
• et coloration au MGG sans délai excessif de lames séchées à l’air.
En cas de besoin (par exemple, recueil d’un liquide en dehors des heures d’ouverture d’un laboratoire) un liquide peut être provisoirement stocké dans un réfrigérateur à + 4 °C.
Étalement des cellules en monocouche
Cette technique moins répandue consiste à recueillir les cellules par ponction (séreuse, organe plein…), ou par frottis (col utérin) et à les transmettre au laboratoire dans un liquide conservateur. Les cellules présentes dans le flacon du fixateur sont ensuite remises en suspension et éventuellement soumises à une dispersion par gradient de densité. Ensuite on effectue un processus de concentration (par filtration et/ou centrifugation). Enfin, les cellules sont transférées en couche mince sur une lame et sur une pastille de taille déterminée.
L’analyse d’un liquide peut également se faire après fixation et inclusion en paraffine d’un culot de centrifugation, qui est alors effectué de la même façon qu’un prélèvement tissulaire.
La technique de prise en charge d’un prélèvement cytologique étant rapide (environ une heure), un résultat urgent peut être donné au médecin prescripteur de l’examen le jour même du prélèvement. Des colorations spéciales et des réactions immunocytochimiques peuvent également être effectuées, à condition de disposer du nombre de lames nécessaires (d’où l’importance des renseignements cliniques fournis à la réception du prélèvement).
Un examen cytopathologique fournit des renseignements souvent partiels, voire sans certitude. Par exemple, les anomalies cytoplasmiques et nucléaires observées dans des cellules cancéreuses, peuvent être difficiles à distinguer de modifications cellulaires induites par des phénomènes inflammatoires ou régénératifs. En outre, lors de l’étude de cellules isolées, des critères importants du diagnostic d’un cancer tels que l’architecture du tissu néoplasique et ses relations avec le tissu sain ne sont pas analysables. L’examen cytopathologique est le plus souvent un examen de dépistage ou d’orientation diagnostique. Un contrôle par biopsie peut être nécessaire avant toute thérapeutique.
Techniques d’étude des tissus
La technique de base comporte plusieurs étapes : la fixation, l’inclusion en paraffine, la confection de coupes et leur coloration. Avant la fixation, il est possible d’effectuer sur le tissu frais des appositions sur lames pour une étude cytopathologique, et des prélèvements pour des techniques particulières :
• la fixation adaptée à la microscopie électronique ;
• la mise en culture pour étude cytogénétique, ou en suspension cellulaire pour étude par cytométrie en flux.
En ce qui concerne les pièces opératoires, une étape d’analyse macroscopique est indispensable, avant (idéalement) ou après la fixation de la pièce.
Étude macroscopique
L’examen macroscopique détaillé est une partie essentielle de l’étude d’une pièce opératoire : la pièce est examinée, mesurée, pesée, palpée puis disséquée (figure 1.8). Chaque lésion est repérée sur un schéma et éventuellement photographiée. Ces constatations sont confrontées aux documents cliniques et/ou radiologiques, ce qui souligne l’importance des renseignements écrits fournis par le médecin clinicien. En cas de pièces opératoires complexes (exérèse monobloc de plusieurs organes, ou pièce de résection selon une méthode non conventionnelle), le chirurgien devra adresser la pièce avec des indications de repérage topographique. Il peut être utile de marquer les berges d’une pièce de résection de tumeur avec une encre indélébile : ceci ne nuit pas à l’étude histologique et permet d’apprécier exactement la distance entre la tumeur et la limite chirurgicale de la pièce (figure 1.9).
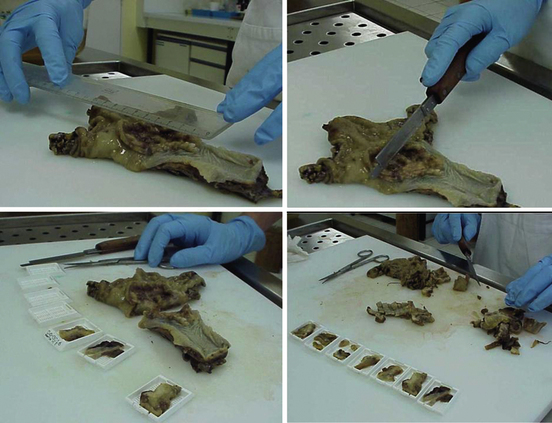
Figure 1.8 Examen macroscopique d’une pièce opératoire : mesure et dissection d’une pièce d’œsogastrectomie fixée dans le formol puis sélection des prélèvements destinés à l’étude microscopique.
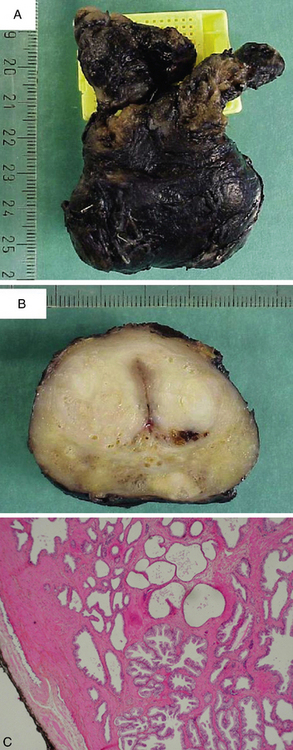
Figure 1.9 Pièce d’exérèse de prostate et de vésicules séminales. A. Surface tatouée à l’encre de chine. B. Tranche de section de la prostate : l’encre ne pénètre pas en profondeur. En bas lors de l’examen microscopique, l’encre permet de repérer exactement les limites de la résection chirurgicale (limite noire à gauche).
L’examen macroscopique donne des indications pour le pronostic de la maladie (notamment la taille et la localisation d’un cancer) et il permet de sélectionner les territoires à prélever pour l’étude microscopique : zones lésées, zones d’aspect macroscopique sain et limites d’exérèse.
Après le choix des prélèvements destinés à l’analyse microscopique, les restes de la pièce opératoire sont conservés pendant quelques jours ou semaines afin de pouvoir en cas de nécessité effectuer des prélèvements complémentaires.
Fixation
La fixation est indispensable pour conserver la morphologie cellulaire, elle doit être immédiate ou au moins très rapidement débutée après l’obtention du prélèvement. Toute fixation défectueuse rend l’étude anatomopathologique difficile voire impossible (dessiccation et/ou autolyse du tissu).
Si le laboratoire est situé à proximité immédiate du lieu de prélèvement, celui-ci peut être acheminé rapidement (moins d’une heure) et confié à l’anatomopathologiste qui choisira les conditions de fixation les plus adaptées. Sinon, la fixation doit être effectuée par le médecin préleveur.
Trois précautions doivent être prises :
1. le volume du fixateur doit représenter environ 10 fois le volume de la pièce ;
2. le récipient doit être de taille suffisamment grande pour prévenir les déformations des pièces opératoires volumineuses ;
3. avant fixation, les organes creux (tube digestif, vésicule biliaire, utérus) doivent être ouverts et si nécessaire lavés de leur contenu afin de prévenir l’autolyse des muqueuses ; les organes pleins volumineux (foie, rate) doivent être coupés en tranches pour faciliter la pénétration rapide et homogène du fixateur, les poumons peuvent être fixés par insufflation d’une solution de formol dans les bronches ou coupés en tranches. Seuls les cerveaux de nécropsies seront plongés dans une solution de formol sans être tranchés en raison de la fragilité de la substance cérébrale.
La durée de la fixation dépend de la taille du prélèvement : au minimum 2 à 5 heures pour une biopsie et 48 heures pour une pièce opératoire.
Nature du fixateur : le fixateur le plus habituellement utilisé est le formol à 10 % tamponné. Pour les biopsies de petites tailles, des fixateurs à base d’alcool peuvent être utilisés (fixation encore plus rapide, mais effet délétère sur certains antigènes, ce qui peut nuire à des techniques particulières d’immunohistochimie).
Cas particuliers des tissus calcifiés : les prélèvements calcifiés (os, certaines tumeurs) doivent être sciés, puis fixés, puis plongés dans une solution décalcifiante (acide) avant d’être inclus dans la paraffine, ce qui rallonge la durée de la technique.
Imprégnation et inclusion
Les prélèvements ayant achevé leur fixation sont déposés dans des cassettes en plastique, directement s’il s’agit de biopsies ou, s’il s’agit de pièces opératoires, après l’étape d’examen macroscopique au cours de laquelle sont prélevés des fragments de petite taille (en moyenne 2 × 0,3 cm). Puis les tissus contenus dans les cassettes sont déshydratés par passage dans des alcools, l’alcool est éliminé par des solvants (xylène), puis la paraffine liquide à 56 °C imprègne les tissus et est refroidie. Ces étapes sont automatisées dans des appareils à inclusion. L’étape finale de l’inclusion est manuelle et consiste à réorienter convenablement le fragment tissulaire dans le sens de la coupe dans un moule de paraffine (figure 1.10).
Coupes et colorations
Le bloc solide de paraffine contenant le tissu est coupé grâce à un microtome, les coupes de 3 à 5 microns d’épaisseur sont étalées sur des lames (figure 1.11). Après dissolution de la paraffine, puis réhydratation, le tissu est coloré. La coloration usuelle associe un colorant basique nucléaire (hématéine, hématoxyline) et un colorant acide cytoplasmique (éosine, érythrosine, ou phloxine). On y ajoute souvent du safran qui se fixe sur le collagène (figure 1.12). La coupe colorée est protégée par une lamelle de verre collée, ou par un film plastique transparent (figure 1.13). Elle est alors prête à être analysée au microscope par un médecin anatomopathologiste.

Figure 1.11 Technique histologique : étapes manuelles. En haut : coupe au microtome. En bas : étalement.
Techniques particulières
Examen histologique extemporané
Il s’agit d’un examen anatomopathologique pratiqué dès que le prélèvement est effectué, non fixé, pendant une intervention chirurgicale, afin de fournir rapidement au chirurgien un diagnostic susceptible de modifier le déroulement de l’acte chirurgical.
Les motifs les plus fréquents de demandes d’examens histologiques extemporanés sont :
• déterminer la nature inflammatoire ou tumorale d’une lésion et, en cas de tumeur, sa nature bénigne ou cancéreuse pour déterminer l’importance du geste d’exérèse chirurgical ;
• s’assurer qu’une biopsie chirurgicale a bien intéressé un territoire lésionnel représentatif de la maladie ;
La technique utilise la macroscopie et, le plus souvent, des coupes au cryomicrotome (cryostat) et une coloration rapide, ce qui permet un résultat en moins de 30 min (figure 1.14).
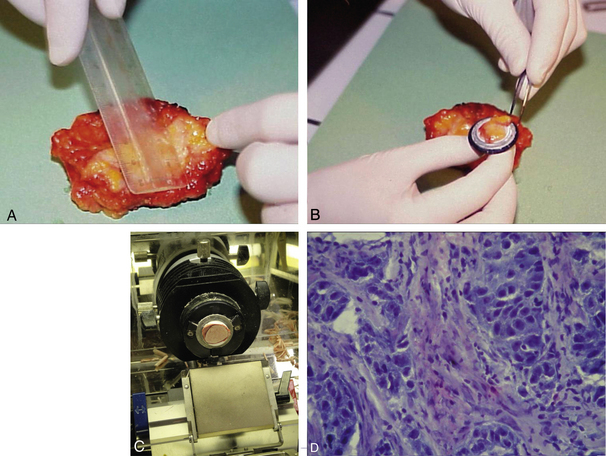
Figure 1.14 Examen histologique extemporané. A. Étude macroscopique du prélèvement frais. B. Un fragment est prélevé et fixé sur un portoir. C. Le fragment congelé est coupé dans un cryostat. D. Coupe de tissu congelé colorée au bleu de toluidine.
Cependant au cours d’un examen extemporané, la morphologie tissulaire n’est pas d’aussi bonne qualité qu’après une fixation et inclusion en paraffine, en raison de la congélation qui altère la morphologie cellulaire. En outre, pour respecter un délai de réponse court, il n’est pas possible d’examiner en totalité une lésion volumineuse. Le diagnostic fourni par un examen extemporané n’est donc pas aussi fiable qu’un diagnostic histologique conventionnel : il ne doit être considéré que comme un diagnostic de présomption.
Les tissus calcifiés ne peuvent être coupés dans un cryostat et ne peuvent donc pas faire l’objet d’un examen histologique extemporané.
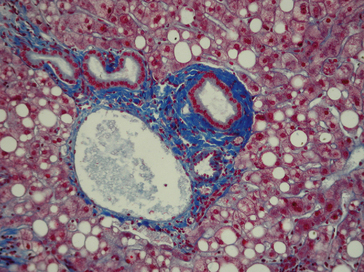
Colorations histochimiques spéciales
Des colorations spéciales ont pour but de mettre en évidence des constituants particuliers des cellules (glycogène, mucus, pigments, etc.), ou de la matrice extra-cellulaire (collagènes, fibres élastiques, amylose, etc.), ainsi que des agents infectieux (bactéries, parasites, champignons). Ces colorations sont très variées (tableau 1.1) et leur mise en œuvre rallonge le processus technique (figures 1.15–1.25).
Tableau 1.1 Liste des colorations histochimiques les plus courantes.
| Nom de la coloration | Nature des principales substances colorées |
|---|---|
| PAS | Glycogène/mucines neutres/champignons |
| Bleu Alcian | Mucines acides |
| Rouge Congo | Amylose |
| Von Kossa | Sels de calcium |
| Perls | Hémosidérine (fer ferrique) |
| Fontana-Masson | Mélanine, lipofuscines |
| Trichrome de Masson | Collagènes |
| Picrosirius | Collagènes |
| Gomori, Weigert | Fibres élastiques |
| Gordon-Sweet, Wilder | Fibres de réticuline, membranes basales |
| Rouge à l’huile | Triglycérides |
| Ziehl | Mycobactéries |
| Grocott | Champignons, certains parasites |
| Whartin-Starry | Certaines bactéries |
| Gram | Certaines bactéries |
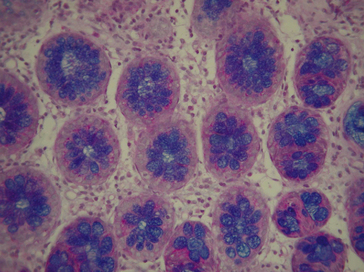
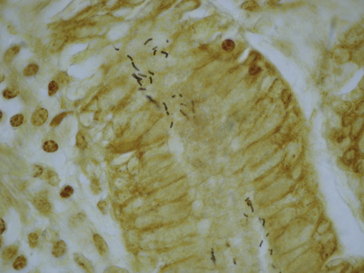
Figure 1.15 Coloration de PAS-bleu Alcian sur les cellules caliciformes mucisécrétantes de la muqueuse intestinale.
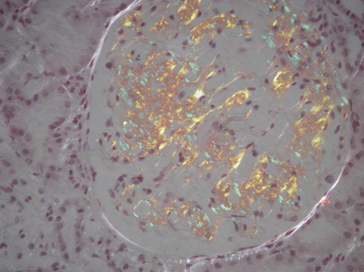
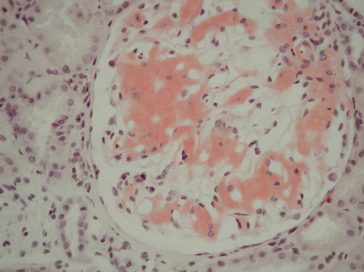
Figure 1.17 Coloration de rouge Congo d’une amylose glomérulaire : aspect dichroïque vert-jaune des dépôts amyloïdes en lumière polarisée.
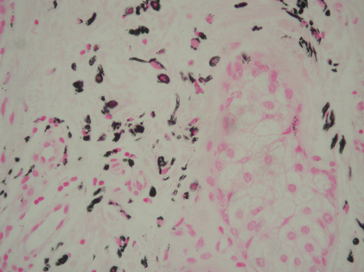
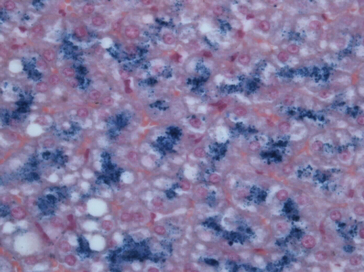
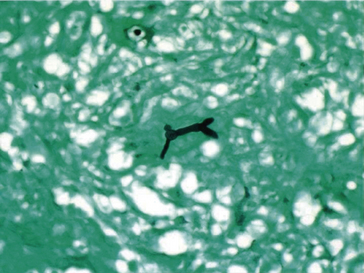
Figure 1.19 Coloration de Fontana-Masson sur un nævus nævocellulaire cutané : mélanocytes chargés de mélanine (noire) autour d’une glande sébacée.
Histoenzymologie
Certains enzymes peuvent être mis en évidence sur des coupes congelées ou parfois après inclusion dans la paraffine. La coupe est incubée dans un substrat spécifique de l’activité enzymatique recherchée. La réaction libère un produit coloré, ou colorable, qui peut être visualisé au microscope optique. L’application la plus courante est l’étude des biopsies musculaires pour myopathies.
Immunohistochimie
L’immunohistochimie consiste à mettre en évidence divers antigènes (Ag) cellulaires, ou extra-cellulaires, grâce à des anticorps (Ac) spécifiquement dirigés contre eux, sur des préparations cytologiques (immunocytochimie), ou sur des coupes de tissus congelés, ou fixés, et inclus en paraffine. Les Ag recherchés peuvent être des Ag membranaires, cytoplasmiques ou nucléaires, ou des protéines de la matrice extra-cellulaire.
L’immunofluorescence directe est surtout utilisée pour mettre en évidence les dépôts tissulaires d’immunoglobulines et de complément dans les biopsies cutanées et dans les biopsies rénales congelées, observées grâce à un microscope à fluorescence (figure 1.26).
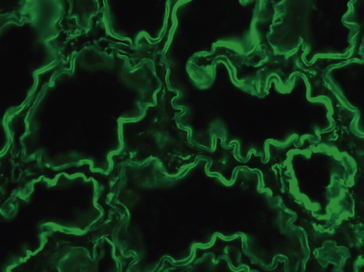
Figure 1.26 Immunofluorescence sur une biopsie rénale congelée : mise en évidence de dépôts anormaux de chaînes légères kappa dans les membranes basales des tubes (maladie des dépôts de chaînes légères d’immunoglobulines).
Dans les méthodes immunoenzymatiques indirectes, l’Ac spécifique primaire est déposé sur le tissu, puis il est révélé par un 2e Ac couplé à une enzyme à laquelle on fournit son substrat. Le produit coloré de la réaction enzymatique apparaît au niveau du site des complexes Ag-Ac (figure 1.27).
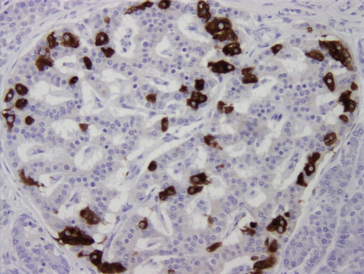
Figure 1.27 Mise en évidence immunohistochimique de l’insuline dans un îlot de Langerhans (technique d’immunoperoxydase sur tissu pancréatique fixé et déparaffiné).
L’intensité du signal obtenu après marquage d’une réaction antigène-anticorps dépend du nombre de molécules colorées visibles. Plusieurs mécanismes d’amplification sont possibles, parmi lesquels les méthodes à trois couches, ou l’utilisation de polymères portant plusieurs molécules d’anticorps. L’augmentation du temps d’incubation et le prétraitement des coupes déparaffinées par la chaleur ou des enzymes augmentent aussi l’intensité du signal.
L’immunohistochimie est très largement utilisée avec de multiples indications parmi lesquelles :
• intérêt diagnostique : classification précise de nombreuses tumeurs par la mise en évidence d’antigènes de différenciation cellulaire, mise en évidence de certains agents infectieux ;
• intérêt pronostique : mise en évidence de protéines impliquées dans la prolifération cellulaire, ou de produits d’oncogènes ;
• intérêt thérapeutique : mise en évidence de cibles thérapeutiques, telles que les récepteurs nucléaires aux estrogènes et la protéine Her2 dans les cancers du sein.
Techniques de biologie moléculaire in situ
Mise en évidence sur des coupes tissulaires (en congélation, ou après inclusion dans la paraffine), ou sur des étalements cellulaires, de séquences d’ARN ou d’ADN grâce à des sondes d’acides nucléiques complémentaires et couplées à un traceur radioactif (sondes chaudes), ou à une enzyme (sondes froides), ou un fluorochrome (sondes fluorescentes). Le terme in situ indique que la détection s’effectue au sein du chromosome en configuration native, à la différence des techniques d’étude d’acides nucléiques extraits sur gels.
L’hybridation in situ classique a relativement peu d’indications car un grand nombre de copies de l’acide nucléique doit être présent dans la cellule pour qu’une réaction positive soit obtenue. Elle peut être utilisée pour mettre en évidence des acides nucléiques viraux (HPV, EBV), ou des ARN de chaînes légères d’immunoglobulines.
L’hybridation in situ fluorescente (FISH) ou l’hybridation in situ chromogénique (CISH) peuvent se faire sur des suspensions cellulaires, des empreintes, ou des coupes congelées ou déparaffinées, et permettent d’identifier dans chaque cellule la présence et le nombre de copies d’un segment chromosomique donné et, en utilisant des fluorochromes différents, d’apprécier une éventuelle co-localisation. Elles sont de plus en plus utilisées pour rechercher des anomalies chromosomiques variées (polysomies, monosomies), ou géniques (délétions ou amplifications de certains gènes, translocations), anomalies qui peuvent avoir dans certaines tumeurs une valeur diagnostique ou pronostique.
Techniques de biologie moléculaire
L’analyse morphologique des prélèvements cellulaires et tissulaires peut être complétée par des analyses utilisant des techniques non morphologiques de biologie moléculaire (recherche de clonalité, de perte d’hétérozygotie, de mutations, de réarrangements, etc.). Ces techniques sont réalisées soit au sein des laboratoires de pathologie, soit dans des départements de biologie moléculaire en relation étroite avec des pathologistes. Toutes ces analyses (sur cellules isolées, tissu frais, congelé ou fixé) doivent impérativement être effectuées après un contrôle morphologique du prélèvement analysé. Si le prélèvement est très hétérogène, ou si les cellules pathologiques sont rares, il est parfois nécessaire de le microdisséquer. Pour un patient donné, les résultats de ces techniques vont participer à l’établissement du diagnostic, à l’évaluation du pronostic ou permettre de guider les décisions de prise en charge thérapeutique.
Résultats : le compte-rendu anatomopathologique
Les résultats de l’analyse anatomopathologique sont donnés sous la forme d’un compte-rendu écrit, dans lequel les lésions sont décrites, puis interprétées, avec le cas échéant une description des méthodes complémentaires utilisées, pour aboutir à une conclusion synthétique : diagnostic lésionnel ou hypothèses de diagnostic en fonction des renseignements fournis et des lésions observées. Chaque fois que cela est nécessaire (en particulier pour des tumeurs) des éléments de pronostic doivent être fournis. L’usage de terminologies et classifications nationales et internationales est recommandé. Le diagnostic morphologique doit toujours être confronté avec la clinique et, le cas échéant, la biologie et l’imagerie.
Le délai de réponse nécessaire, en raison des diverses contraintes techniques, est généralement de l’ordre de 48 heures au minimum. En cas de délai prolongé (examen en attente de techniques complémentaires ou demande d’avis auprès d’un expert), un compte-rendu provisoire peut être adressé, mais une décision thérapeutique ne peut s’appuyer que sur le compte-rendu définitif.
Déontologie et aspects législatifs
Le compte-rendu anatomocytopathologique est daté et signé par le médecin habilité qui a effectué l’examen et est adressé au médecin prescripteur de l’examen, éventuellement aux autres médecins en charge du patient. Le compte-rendu devient un élément du dossier médical du patient et est couvert par le secret médical. Les communications de comptes-rendus par télécopie ou par réseau informatique ne peuvent être utilisées que dans le cadre d’une procédure garantissant ce secret.
L’avis d’autres médecins anatomopathologistes peut être sollicité dans diverses circonstances : cas de diagnostic difficile, désaccord sur le diagnostic entre le pathologiste et le clinicien, avis d’un autre pathologiste sollicité à la demande du clinicien ou du patient. Cela nécessite l’envoi de lames, de blocs ou d’images numériques. Le pathologiste consulté rédige un compte-rendu écrit qui est adressé au pathologiste initial et est transmis au médecin en charge du patient.
Les résidus de pièces opératoires ou de prélèvements nécropsiques sont détruits après l’analyse anatomopathologique mais les blocs d’inclusion, les lames colorées et les comptes-rendus sont conservés par le laboratoire dans des archives : il s’agit d’une obligation légale. Après des années, il est donc toujours possible de réexaminer des lames ou de confectionner de nouvelles lames à partir du bloc d’inclusion tant que le matériel tissulaire n’est pas épuisé par les coupes successives.
Place de l’anatomopathologie dans la prise en charge pluridisciplinaire du patient
Des réunions de concertation pluridisciplinaire régulières organisées entre cliniciens et pathologistes permettent de confronter le diagnostic morphologique aux données cliniques, d’imagerie, ou de biologie moléculaire. Elles peuvent être formalisées au sein de réseaux cliniques ville hôpital, pour la prise en charge de pathologies ciblées, ou en cancérologie. Dans ce cadre, l’anatomopathologiste participe aux confrontations pluridisciplinaires avec les radiologues, chirurgiens et oncologues.
Seule une mise en commun des données permet d’assurer au patient un diagnostic fiable, une prise en charge de qualité (recherche de facteurs influençant le pronostic) et de proposer une stratégie thérapeutique.
Assurance qualité
La nécessité d’actualiser ses connaissances (formation continue) et la démarche d’assurance qualité s’imposent à tout médecin, au travers des articles 32 et 72 du Code de déontologie et de dispositions réglementaires. La recherche de la qualité et de la sécurité des résultats est une préoccupation constante de tout pathologiste. La bonne exécution des actes est une des conditions déterminantes de cette qualité.
Le recours aux bases de données informatisées facilite l’accès à l’information la plus pertinente. Une démarche institutionnelle d’assurance qualité en anatomie et cytologie pathologiques est structurée au sein de l’Association française d’assurance qualité en anatomie et cytologie pathologiques (AFAQAP).
Place de l’anatomie pathologique dans la recherche
Le pathologiste doit continuer d’évoluer, comme il l’a toujours fait, en enrichissant la sémiologie morphologique des nouvelles méthodes diagnostiques, mais il doit garder un raisonnement précis fondé sur la morphologie (tant macroscopique, que microscopique), pour établir ou réviser les arbres décisionnels.
Cryopréservation des tissus
La congélation d’échantillons est habituellement faite dans un but diagnostique (immédiat ou principe de précaution pour donner au patient une chance supplémentaire, fonction de l’évolution des connaissances), mais aussi pour la recherche et/ou la constitution d’une collection (tissuthèques, tumorothèques, centres de ressources biologiques).
La conservation des prélèvements cryopréservés nécessite une infrastructure lourde, garantissant en particulier la rapidité de congélation, le contrôle de la qualité des prélèvements congelés, et leur conservation dans des conditions satisfaisantes. L’utilisation de ces collections nécessite la conformité aux règles éthiques selon la loi (information du patient, gestion du consentement), aux procédures d’assurance qualité et à la transparence des règles d’organisation, de fonctionnement et d’utilisation des prélèvements conservés. Les échantillons cellulaires ou tissulaires, cryopréservés ou non, ne peuvent être utilisés ou utilisables que s’ils sont associés à des informations cliniques sur le malade, des informations morphologiques concernant le diagnostic porté sur le prélèvement et des informations sur les échantillons (nature, quantité, conditions de collecte, de préparation, de conservation et d’utilisation).
Techniques d’analyse en recherche
Au cours des deux dernières décennies, les techniques d’investigation morphologique se sont considérablement développées. La liste des techniques complémentaires pouvant être utilisée est longue et non exhaustive.
Certaines techniques peuvent avoir des applications dans le diagnostic de routine (microscopie électronique, cytométrie en flux, morphométrie). D’autres restent actuellement du domaine de la recherche (microscopie confocale, microdissection, tissue array, techniques non morphologiques d’analyse du transcriptome ou du protéome, etc.).
Microscopie électronique
Cette technique, par l’utilisation de coupes tissulaires très fines (moins de 100 nm) et de grandissements très importants, permet une étude à l’échelon cellulaire (analyse des constituants d’une cellule, des jonctions intercellulaires, d’éventuels dépôts, inclusion etc.). Les prélèvements doivent être de petite taille (2 à 3 mm), des fixateurs spéciaux doivent être utilisés (glutaraldéhyde, puis acide osmique le plus souvent) avant l’inclusion dans une résine. Des techniques d’immunohistochimie peuvent être adaptées au microscope électronique (notamment par des systèmes de révélation utilisant des billes d’or colloïdal denses aux électrons).
L’utilisation du microscope électronique à visée diagnostique est actuellement très réduite (pathologies rares neuromusculaires, rénales ou de surcharge) et elle a été supplantée par l’immunohistochimie, qui permet d’obtenir des résultats plus précis, beaucoup plus rapidement et à moindre coût.
Histomorphométrie
Cette technique permet une évaluation quantitative de certains paramètres : étude de la masse osseuse, quantification de la quantité de tissu conjonctif fibreux, étude de caractères morphologiques cellulaires (taille des noyaux), quantification de résultats immuno-histochimiques. Elle utilise des appareils semi-automatiques couplés à des ordinateurs.
Microscopie confocale à balayage laser
Le microscope confocal à balayage laser est un microscope à fluorescence dont le faisceau lumineux est généré par un laser. Les signaux transmis sont captés, numérisés et un logiciel permet de reconstituer les images. Le microscope confocal permet une analyse morpho-fonctionnelle des cellules et des tissus, par la quantification des intensités des marquages fluorescents et la détection de leur localisation, ou co-localisation précise au sein des constituants cellulaires.
Lames virtuelles
Ce sont des reproductions numériques d’une lame, obtenues par la juxtaposition de très nombreuses images, acquises automatiquement et successivement, à fort grandissement. Ces images numériques peuvent ensuite être facilement consultées par plusieurs pathologistes. C’est une technologie très utile pour l’enseignement, la relecture de cas lors de protocoles thérapeutiques ou en assurance qualité pour l’analyse de la reproductibilité diagnostique.
Cytométrie en flux
C’est l’étude des cellules en suspension entraînées dans un flux et interceptées par un faisceau lumineux émis par un laser. Le faisceau modifié est détecté, amplifié et converti en signaux électriques traités par un ordinateur. Les suspensions cellulaires peuvent provenir de liquides naturels ou d’épanchements pathologiques, du broyage de tissu frais ou congelé ou de la dissociation enzymatique de coupes épaisses (70–100 μm) de blocs de paraffine. L’analyse directe des constituants de la cellule permet de déterminer des paramètres à valeur pronostique en cancérologie : phase S, ploïdie. Des populations cellulaires peuvent être étudiées après incubation avec des Ac spécifiques couplés à un fluorochrome : une application possible est la détermination des antigènes membranaires caractéristiques des sous-populations cellulaires, normales ou tumorales dans le sang, la moelle osseuse, ou dans une suspension cellulaire issue d’un ganglion lymphatique.
PCR in situ
Elle combine, sur des coupes histologiques, une amplification de type PCR et une hybridation in situ. Cette technique, très sensible, est d’un maniement difficile, qui empêche encore actuellement son utilisation en routine.
Microdissection
Elle permet de réaliser des analyses moléculaires ciblées. Elle est notamment utilisée lorsque le prélèvement est très hétérogène, pour ne prélever sur une lame que les territoires ou les cellules que l’on souhaite analyser. Cette microdissection peut être soit manuelle, soit par faisceau laser.
Bloc de tissue microarrays et les techniques non morphologiques
Le bloc de tissue microarrays est un bloc de paraffine comportant des carottes de 0,6 à 4 mm de diamètre, alignées dans un ordre, repéré dans un bloc receveur (figure 1.28). Ces blocs, comportant de nombreuses tumeurs, permettent de valider facilement de nouveaux marqueurs.
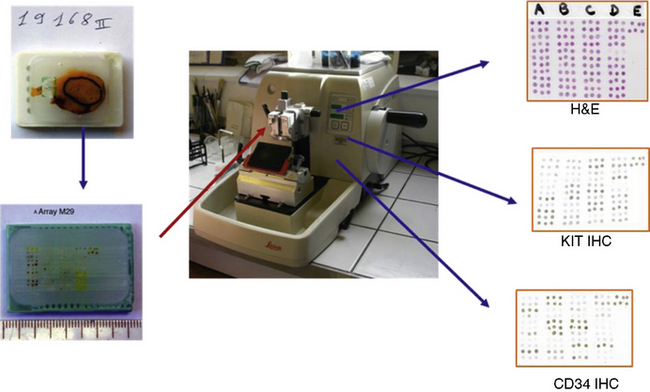
Figure 1.28 Bloc de tissue microarray (en bas, à gauche) à partir duquel sont réalisées une coloration HE et une étude immunohistochimique avec des anticorps anti-KIT et anti-CD34 (à droite).
L’analyse de la signature moléculaire d’une lésion, fondée sur l’étude du transcriptome (étude à grande échelle des ARN extraits des tissus par biopuces ou PCR quantitative) est facilitée par les puces à ADN et le développement de puces dédiées avec un nombre restreint de gènes.
L’analyse du protéome avec des appareils de spectrométrie de masse de type SELDI-TOF (surface enhanced laser desorption/ionization time of flight) se développe, avec pour principe de séparer les protéines par leurs propriétés chimiques et leur masse moléculaire avant d’analyser les protéines d’intérêt.
Épidémiologie, les registres
Par l’utilisation du codage systématique des lésions, les bases de données anatomopathologiques (système informatisé de gestion de laboratoire) constituent une base fiable, facilement exploitable pour l’épidémiologie (fréquence, prévalence des maladies). Ces données ne peuvent être exploitées que de manière anonyme et en accord avec la CNIL. Les pathologistes sont souvent sollicités pour participer à des enquêtes à l’échelon national (institut de veille sanitaire) sur une pathologie donnée.
 L’anatomocytopathologie est une discipline médicale qui étudie les lésions provoquées par les maladies sur les organes, tissus ou cellules, en utilisant des techniques principalement fondées sur la morphologie macroscopique et microscopique. Une lésion élémentaire correspond à l’altération morphologique d’une structure analysée isolément. L’association de différentes lésions élémentaires constitue un ensemble lésionnel. Les lésions sont confrontées aux données cliniques, biologiques et d’imagerie : c’est la corrélation anatomoclinique qui est indispensable pour permettre une interprétation synthétique et aboutir à un diagnostic. Le rôle du pathologiste est de contribuer à élaborer le diagnostic, à préciser le pronostic et à évaluer l’effet des thérapeutiques. Les résultats de l’analyse anatomopathologique sont donnés sous la forme d’un compte-rendu écrit, dans lequel les lésions sont décrites, puis interprétées pour aboutir à une conclusion synthétique : diagnostic lésionnel ou hypothèses de diagnostic en fonction des renseignements fournis et des lésions observées. Chaque fois que cela est nécessaire (en particulier pour des tumeurs) des éléments de pronostic doivent être fournis. L’usage de terminologies et classifications nationales et internationales est recommandé. Le diagnostic morphologique doit toujours être confronté avec la clinique et, le cas échéant, la biologie et l’imagerie.
L’anatomocytopathologie est une discipline médicale qui étudie les lésions provoquées par les maladies sur les organes, tissus ou cellules, en utilisant des techniques principalement fondées sur la morphologie macroscopique et microscopique. Une lésion élémentaire correspond à l’altération morphologique d’une structure analysée isolément. L’association de différentes lésions élémentaires constitue un ensemble lésionnel. Les lésions sont confrontées aux données cliniques, biologiques et d’imagerie : c’est la corrélation anatomoclinique qui est indispensable pour permettre une interprétation synthétique et aboutir à un diagnostic. Le rôle du pathologiste est de contribuer à élaborer le diagnostic, à préciser le pronostic et à évaluer l’effet des thérapeutiques. Les résultats de l’analyse anatomopathologique sont donnés sous la forme d’un compte-rendu écrit, dans lequel les lésions sont décrites, puis interprétées pour aboutir à une conclusion synthétique : diagnostic lésionnel ou hypothèses de diagnostic en fonction des renseignements fournis et des lésions observées. Chaque fois que cela est nécessaire (en particulier pour des tumeurs) des éléments de pronostic doivent être fournis. L’usage de terminologies et classifications nationales et internationales est recommandé. Le diagnostic morphologique doit toujours être confronté avec la clinique et, le cas échéant, la biologie et l’imagerie.
 Il existe différents types de prélèvements cytologiques : le recueil d’un liquide spontanément émis (ex : urine, liquide de drain, expectoration) ; le raclage, brossage, écouvillonnage ou aspiration de cellules desquamant spontanément (ex : frottis de col utérin, aspiration après lavage bronchoalvéolaire) ; la ponction à l’aiguille d’un liquide (ex : ponction de liquide pleural, ponction lombaire) ; la ponction à l’aiguille d’un organe ou d’une tumeur (ex : cytoponction dirigée sur un nodule thyroïdien) ; l’apposition d’un tissu sur une lame (ex : apposition d’un tissu ganglionnaire).
Il existe différents types de prélèvements cytologiques : le recueil d’un liquide spontanément émis (ex : urine, liquide de drain, expectoration) ; le raclage, brossage, écouvillonnage ou aspiration de cellules desquamant spontanément (ex : frottis de col utérin, aspiration après lavage bronchoalvéolaire) ; la ponction à l’aiguille d’un liquide (ex : ponction de liquide pleural, ponction lombaire) ; la ponction à l’aiguille d’un organe ou d’une tumeur (ex : cytoponction dirigée sur un nodule thyroïdien) ; l’apposition d’un tissu sur une lame (ex : apposition d’un tissu ganglionnaire).
 Il existe différents types de prélèvements tissulaires : une ponction-biopsie d’un organe plein qui permet l’analyse d’une carotte tissulaire (ex : ponction-biopsie de foie, de rein) ; une biopsie chirurgicale (ex : biopsie sous capsulaire hépatique lors d’une laparotomie, biopsie exérèse d’un ganglion lymphatique) ; une biopsie à la pince réalisée au cours d’une endoscopie (ex : biopsie bronchique, biopsie gastrique) ; une pièce de résection partielle ou complète d’un ou plusieurs organes (ex : segmentectomie hépatique, prostatectomie, cholécystectomie, duodénopancréatectomie céphalique) ; les prélèvements réalisés au cours d’une autopsie.
Il existe différents types de prélèvements tissulaires : une ponction-biopsie d’un organe plein qui permet l’analyse d’une carotte tissulaire (ex : ponction-biopsie de foie, de rein) ; une biopsie chirurgicale (ex : biopsie sous capsulaire hépatique lors d’une laparotomie, biopsie exérèse d’un ganglion lymphatique) ; une biopsie à la pince réalisée au cours d’une endoscopie (ex : biopsie bronchique, biopsie gastrique) ; une pièce de résection partielle ou complète d’un ou plusieurs organes (ex : segmentectomie hépatique, prostatectomie, cholécystectomie, duodénopancréatectomie céphalique) ; les prélèvements réalisés au cours d’une autopsie.
 Différentes étapes techniques successives sont un préalable à l’analyse microscopique d’un prélèvement cellulaire :
Différentes étapes techniques successives sont un préalable à l’analyse microscopique d’un prélèvement cellulaire :
 Différentes étapes techniques successives sont un préalable à l’analyse microscopique d’un prélèvement tissulaire :
Différentes étapes techniques successives sont un préalable à l’analyse microscopique d’un prélèvement tissulaire :
 La qualité des prélèvements conditionne la qualité de l’étude anatomopathologique. Le médecin préleveur et prescripteur a une responsabilité dans l’acte anatomopathologique en s’assurant de la bonne réalisation technique du prélèvement et de son acheminement dans de bonnes conditions au laboratoire (dans des délais brefs, en respectant les règles de fixation, accompagné d’une demande d’examen correctement renseignée).
La qualité des prélèvements conditionne la qualité de l’étude anatomopathologique. Le médecin préleveur et prescripteur a une responsabilité dans l’acte anatomopathologique en s’assurant de la bonne réalisation technique du prélèvement et de son acheminement dans de bonnes conditions au laboratoire (dans des délais brefs, en respectant les règles de fixation, accompagné d’une demande d’examen correctement renseignée).
 La fixation est indispensable pour conserver la morphologie cellulaire, elle doit être immédiate ou au moins très rapidement débutée après l’obtention du prélèvement. Toute fixation défectueuse rend l’étude anatomopathologique difficile, voire impossible (dessiccation et/ou autolyse du tissu). Si le laboratoire est situé à proximité immédiate du lieu de prélèvement, celui-ci peut être acheminé rapidement (moins d’une heure) et confié à l’anatomopathologiste qui choisira les conditions de fixation les plus adaptées. Sinon, la fixation doit être effectuée par le médecin préleveur.
La fixation est indispensable pour conserver la morphologie cellulaire, elle doit être immédiate ou au moins très rapidement débutée après l’obtention du prélèvement. Toute fixation défectueuse rend l’étude anatomopathologique difficile, voire impossible (dessiccation et/ou autolyse du tissu). Si le laboratoire est situé à proximité immédiate du lieu de prélèvement, celui-ci peut être acheminé rapidement (moins d’une heure) et confié à l’anatomopathologiste qui choisira les conditions de fixation les plus adaptées. Sinon, la fixation doit être effectuée par le médecin préleveur.
 L’examen cytopathologique est le plus souvent un examen de dépistage ou d’orientation diagnostique. Un contrôle par biopsie peut être nécessaire. Cet examen cytopathologique permet d’analyser les caractéristiques cytoplasmiques et nucléaires des cellules isolées de leur contexte tissulaire. Les anomalies observées dans des cellules cancéreuses peuvent être difficiles à distinguer de modifications cellulaires induites par des phénomènes inflammatoires.
L’examen cytopathologique est le plus souvent un examen de dépistage ou d’orientation diagnostique. Un contrôle par biopsie peut être nécessaire. Cet examen cytopathologique permet d’analyser les caractéristiques cytoplasmiques et nucléaires des cellules isolées de leur contexte tissulaire. Les anomalies observées dans des cellules cancéreuses peuvent être difficiles à distinguer de modifications cellulaires induites par des phénomènes inflammatoires.
 L’examen extemporané correspond à un examen anatomopathologique pratiqué dès que le prélèvement est effectué, non fixé, pendant une intervention chirurgicale, afin de fournir rapidement au chirurgien un diagnostic susceptible de modifier le déroulement de l’acte chirurgical. Au cours d’un examen extemporané, la morphologie tissulaire n’est pas d’aussi bonne qualité qu’après une fixation et inclusion en paraffine, en raison de la congélation qui altère la morphologie cellulaire. En outre, pour respecter un délai de réponse court, il n’est pas possible d’examiner en totalité une lésion volumineuse. Le diagnostic fourni par un examen extemporané n’est donc pas aussi fiable qu’un diagnostic histologique conventionnel : il ne doit être considéré que comme un diagnostic de présomption.
L’examen extemporané correspond à un examen anatomopathologique pratiqué dès que le prélèvement est effectué, non fixé, pendant une intervention chirurgicale, afin de fournir rapidement au chirurgien un diagnostic susceptible de modifier le déroulement de l’acte chirurgical. Au cours d’un examen extemporané, la morphologie tissulaire n’est pas d’aussi bonne qualité qu’après une fixation et inclusion en paraffine, en raison de la congélation qui altère la morphologie cellulaire. En outre, pour respecter un délai de réponse court, il n’est pas possible d’examiner en totalité une lésion volumineuse. Le diagnostic fourni par un examen extemporané n’est donc pas aussi fiable qu’un diagnostic histologique conventionnel : il ne doit être considéré que comme un diagnostic de présomption.
QCM 3
L’examen anatomopathologique extemporané effectué au cours d’un acte chirurgical :
A. Est réalisé sur un prélèvement tissulaire fixé dans du formol
B. Nécessite l’inclusion en paraffine du prélèvement fixé
C. Permet de fournir un diagnostic rapide susceptible de modifier le déroulement d’un acte chirurgical
D. Peut être indiqué pour vérifier, au cours de l’acte chirurgical, que les limites d’exérèse d’une lésion tumorale sont saines
QCM 4
Parmi les propositions suivantes, laquelle (lesquelles) peut (peuvent) s’appliquer à l’examen d’une préparation dite cytologique ?
A. Il permet l’évaluation des anomalies architecturales du tissu où les prélèvements ont été effectués
B. C’est l’examen de cellules isolées après étalements sur lames
C. C’est le test idéal pour le dépistage des cancers du col utérin
D. Il est habituellement peu coûteux
E. Il permet de faire un diagnostic de malignité de certitude avant chirurgie large ou chimiothérapie
QCM 5
La cytoponction à l’aiguille des organes :
A. Permet d’obtenir des étalements cytologiques examinés après coloration
B. Est une méthode de dépistage de masse des cancers
C. Permet d’orienter sur la nature bénigne ou maligne d’une lésion nodulaire sur laquelle la cytoponction est dirigée
D. Permet d’orienter sur le caractère primitif ou secondaire d’une tumeur
QCM 6
Parmi les propositions suivantes concernant la fixation tissulaire, laquelle (lesquelles) est (sont) exacte(s) ?
QCM 8
En pathologie tumorale, l’étude immunohistochimique :
A. Est toujours effectuée sur la tumeur primitive
B. Permet l’identification d’antigènes cellulaires tumoraux
C. Permet de distinguer les tumeurs bénignes des tumeurs malignes
D. Aide à l’évaluation de la différenciation d’une tumeur
E. Peut, dans certains cas, contribuer à prédire la réponse thérapeutique