2 Les facteurs favorisants
COMPRENDRE
INTRODUCTION
L’apparition des maladies dégénératives s’explique de différentes façons. Peuvent contribuer à leur développement : l’exposition à certains facteurs de risque, la durée et l’intensité de cette exposition, les modifications cellulaires et organiques induites par le vieillissement, et les prédispositions génétiques.
FACTEURS PRÉDISPOSANTS
 Vieillissement
Vieillissement
 Définitions
Définitions
« Le vieillissement correspond à l’ensemble des processus physiologiques et psychologiques qui modifient la structure et les fonctions de l’organisme à partir de l’âge mûr. Il est la résultante des effets intriqués de facteurs génétiques (vieillissement intrinsèque) et de facteurs environnementaux auxquels est soumis l’organisme tout au long de sa vie. Il s’agit d’un processus lent et progressif qui doit être distingué des manifestations des maladies11. » Ce processus hétérogène est variable d’un individu à l’autre et d’un organe à l’autre.
La notion de physiologie exclut donc les modifications induites par les maladies. Le vieillissement est progressif, universel, inéluctable et irréversible, même s’il apparaît modulable par certains aspects actuellement12.
 Conséquences
Conséquences
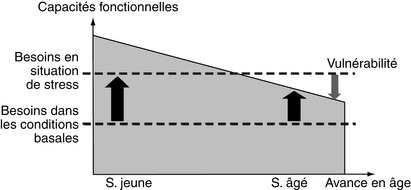
Le vieillissement a pour conséquence de diminuer les capacités de réserves de l’organisme, capacités qui ne sont sollicitées que dans des circonstances telles que le stress, l’effort, les maladies. Il ne s’agit donc pas des capacités fonctionnelles sollicitées en situations « normales » et habituelles. Cependant, certaines personnes conservent, même dans le grand âge, des capacités fonctionnelles optimales.
La notion de réserve, capitale en physiologie, désigne pour certains organes une capacité de réserve de fonctionnement mesurable dans des circonstances déterminées : réserve fonctionnelle rénale, coronaire, myocardique13… La diminution des capacités, en l’absence de pathologie surajoutée, ne provoque pas d’insuffisance. L’âge n’est pas responsable à lui seul de la décompensation d’une fonction, cependant le déclin de la fonction est accéléré en présence de pathologies.
Le vieillissement se caractérise aussi par une perte de flexibilité qui concerne les niveaux moléculaire, cellulaire, et tissulaire. Cette perte a pour conséquence une diminution des capacités des sujets âgés à s’adapter à des situations nouvelles ou à des agressions.
L’âge entraîne des modifications de fonctionnement de l’organisme liées au vieillissement. En effet, la production de cellules destinées à remplacer les cellules mortes ralentit progressivement jusqu’à ce qu’elle devienne inférieure aux besoins de l’organisme, diminuant ainsi lentement la capacité fonctionnelle de chacun des organes. Ainsi, les fonctions neurologique, endocrinienne, sensorielle, cardio-vasculaire, respiratoire, digestive, locomotrice, d’élimination et immunitaire s’amoindrissent au cours du temps. Au total, l’organisme âgé est moins capable de répondre et de faire face à des situations, ce qui correspond à la vulnérabilité (figure 2.1).
Enfin, les progrès médicaux et la prise en charge de certaines pathologies (mais pas seulement)14 contribuent aussi à allonger la vie de personnes qui développeront ultérieurement des maladies dégénératives ou autres (cancers). Or, ces maladies ne seraient pas apparues si la prise en charge médicale (antérieure) n’avait pas diminué la mortalité. Le vieillissement de la population s’accompagne donc d’un accroissement de certaines maladies du fait des effets cumulatifs du temps sur l’organisme. En effet, la durée d’exposition aux facteurs de risque est plus longue, et les modifications induites par le vieillissement favorisent l’apparition de certaines maladies.
Cette illustration démontre que le grand âge rend plus vulnérable, et que parfois des troubles cognitifs apparaissent, signant une maladie neurodégénérative. Si la prise en charge médicale de la pathologie aiguë n’avait pas permis le traitement et donc la survie, les troubles dégénératifs ne se seraient pas révélés. Certaines pathologies sont donc induites par l’allongement de la vie.
![]() M. A., 86 ans, est adressé aux urgences par sa famille pour des troubles du comportement. Sa fille qui l’accompagne indique que depuis qu’il a été opéré d’une coxarthrose, il n’a plus toute sa tête. Elle signale que son père diabétique n’est plus en mesure de suivre son régime. Suite à la pose d’un stent il y a quatre ans, consécutive à une menace d’infarctus du myocarde, il consulte régulièrement un cardiologue, et est fréquemment hospitalisé. Depuis quelques jours, il présente des accès de tristesse avec refus de s’alimenter, et a perdu 3 kg en un mois. D’habitude participatif à la vie de la maison, il ne parvient plus à réaliser ses activités de la vie quotidienne. Son visage figé témoigne d’une intense douleur morale. M. A. répond par des phrases très courtes, dit ne pas bien dormir, rester couché tout au long de la journée et attendre la mort. Des troubles mnésiques sont relevés lors du bilan réalisé, sans justification organique.
M. A., 86 ans, est adressé aux urgences par sa famille pour des troubles du comportement. Sa fille qui l’accompagne indique que depuis qu’il a été opéré d’une coxarthrose, il n’a plus toute sa tête. Elle signale que son père diabétique n’est plus en mesure de suivre son régime. Suite à la pose d’un stent il y a quatre ans, consécutive à une menace d’infarctus du myocarde, il consulte régulièrement un cardiologue, et est fréquemment hospitalisé. Depuis quelques jours, il présente des accès de tristesse avec refus de s’alimenter, et a perdu 3 kg en un mois. D’habitude participatif à la vie de la maison, il ne parvient plus à réaliser ses activités de la vie quotidienne. Son visage figé témoigne d’une intense douleur morale. M. A. répond par des phrases très courtes, dit ne pas bien dormir, rester couché tout au long de la journée et attendre la mort. Des troubles mnésiques sont relevés lors du bilan réalisé, sans justification organique.
La fonction de reproduction suit un schéma différent selon le genre. Chez l’homme, cette fonction – comme les autres – diminue progressivement. La production de testostérone et de spermatozoïdes bien que diminuant permet néanmoins de conserver la capacité à se reproduire, même tardivement. Il n’en va pas de même pour la femme dont la fonction de reproduction s’interrompt irrémédiablement à la ménopause (âge moyen : 51 ans)15. Cet arrêt entraîne pour les femmes un risque accru de pathologies dégénératives, puisque les hormones œstroprogestatives constituent des éléments protecteurs de l’organisme.
![]() L’arthrose16 est plus fréquente chez la femme après 50 ans, alors que cette fréquence diminue lorsque les femmes prennent un traitement substitutif œstroprogestatif. Physiologiquement, les chondrocytes possèdent des récepteurs aux œstrogènes qui lorsqu’ils sont stimulés provoquent la synthèse de facteurs de croissance. Après la ménopause, la concentration plasmatique en œstrogènes diminue, ce qui pourrait a priori provoquer une diminution de synthèse de facteurs de croissance par les chondrocytes. Il est donc supposé qu’un ou plusieurs facteurs hormonaux sont impliqués dans le développement de l’arthrose.
L’arthrose16 est plus fréquente chez la femme après 50 ans, alors que cette fréquence diminue lorsque les femmes prennent un traitement substitutif œstroprogestatif. Physiologiquement, les chondrocytes possèdent des récepteurs aux œstrogènes qui lorsqu’ils sont stimulés provoquent la synthèse de facteurs de croissance. Après la ménopause, la concentration plasmatique en œstrogènes diminue, ce qui pourrait a priori provoquer une diminution de synthèse de facteurs de croissance par les chondrocytes. Il est donc supposé qu’un ou plusieurs facteurs hormonaux sont impliqués dans le développement de l’arthrose.
 Mécanismes du vieillissement
Mécanismes du vieillissement
Actuellement, tous les mécanismes du vieillissement ne sont pas élucidés et plusieurs hypothèses et/ou théories coexistent pour les expliquer. Si la majorité des spécialistes s’accordent sur le fait que le vieillissement n’est pas génétiquement programmé, sa nature multifactorielle implique néanmoins le rôle plus ou moins important de certains gènes quant à la résistance aux facteurs nuisibles impliqués dans le vieillissement.
 Facteurs génétiques
Facteurs génétiques
Le rôle des facteurs héréditaires dans le contrôle du vieillissement a été démontré, notamment chez les jumeaux homozygotes ; cependant, d’autres facteurs ont été identifiés.
On considère actuellement que les altérations acquises de l’acide désoxyribonucléique (ADN), interviendraient dans le phénomène du vieillissement, or la fréquence des altérations de l’ADN (par délétion ou mutation) ainsi que les anomalies de sa réparation augmentent avec l’âge. Les altérations, fréquentes au niveau des mitochondries, seraient induites par des agents extérieurs environnementaux tels que les radiations, les carcinogènes industriels… ou par des facteurs internes comme la division cellulaire. Elles seraient responsables de changements dans le processus de vieillissement.
Les télomères sont aussi repérés comme pouvant être à l’origine de dysfonctionnements. Les extrémités des chromosomes humains sont constituées de télomères, structures d’ADN spéciales et essentielles pour protéger les chromosomes de la recombinaison et de la dégradation. Ainsi contribuent-ils à la stabilité de la structure de l’ADN. Toutefois, tel le bout d’une gomme à effacer, les télomères perdent un fragment d’ADN (donc d’information génétique) à chaque division cellulaire, en raison de leur duplication incomplète. Ce raccourcissement « télomérique » conduit à une instabilité chromosomique et à la perte de la viabilité cellulaire. Ainsi, au fil du temps apparaît une altération de l’ADN qui est une manifestation du vieillissement. Elle se traduit par des modifications du cycle cellulaire et de l’expression de certains gènes.
![]() Des irrégularités dans la longueur des télomères ont été impliquées dans plusieurs types de pathologies liées au vieillissement tels que les cancers.
Des irrégularités dans la longueur des télomères ont été impliquées dans plusieurs types de pathologies liées au vieillissement tels que les cancers.
Ce raccourcissement progressif constituerait pour les scientifiques une « horloge moléculaire » qui sous-tendrait le vieillissement des organismes vivants. Toutefois, il existe une exception dans les cellules germinales (spermatozoïdes et ovocytes) et certaines cellules cancéreuses qui présentent des niveaux élevés de télomérase : enzyme qui empêche le raccourcissement des télomères et maintient la vie cellulaire malgré l’âge17.
 Radicaux libres et stress biologique
Radicaux libres et stress biologique
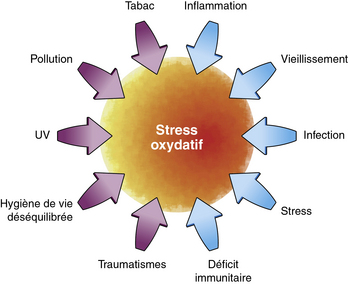
La théorie du stress oxydatif et des radicaux libres reliés au vieillissement a d’abord été proposée par le Dr Harman en 1956. Celle-ci stipulait que l’âge et la perte de la fonction physiologique étaient dus à l’accumulation progressive de dommages oxydatifs. Actuellement, cette théorie implique la surproduction de radicaux libres et les dommages subséquents qu’ils causent aux structures cellulaires, aux macromolécules, et en particulier à l’ADN mitochondrial (ADNmt) (figure 2.2).
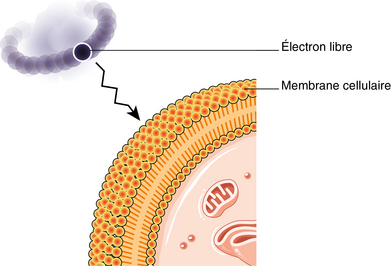
Les radicaux libres, atomes ou molécules ayant un électron non apparié, sont des éléments fabriqués par les mitochondries lors de la production d’énergie. Cette production met en jeu de nombreuses réactions chimiques à partir d’oxygène et d’hydrogène. Les radicaux libres, avides d’électrons, vont en trouver au sein de molécules saines qu’ils « attaquent ». Cette attaque constitue le stress oxydatif, elle est favorisée par le tabac, les rayons UV, la pollution et une consommation excessive de sucres et de graisses. Les radicaux libres s’attaquent particulièrement aux acides gras des membranes cellulaires et à l’ADN. Il existe des antioxydants, comme des enzymes (superoxyde dismutase, la catalase) et les vitamines A, C et E qui neutralisent les radicaux libres en leur fournissant les électrons dont ils ont besoin. Cependant, avec l’âge, l’équilibre entre radicaux libres et antioxydants est rompu (figure 2.3).
Les radicaux libres constituent des déchets métaboliques qui entraînent des lésions quand ils s’accumulent. En effet, dans des conditions normales les radicaux libres sont rapidement détruits par des systèmes d’enzymes protecteurs. Cependant, certains radicaux libres échappent à la destruction et s’accumulent dans des structures biologiques où surviennent des lésions. En conséquence, l’accumulation de mutations dans l’ADNmt conduirait à la production de mitochondries défectueuses, à des lésions oxydatives irréversibles et à la mort cellulaire, cette dernière affectant l’environnement immédiat de l’organe.
 Glycation ou glycosylation non enzymatique
Glycation ou glycosylation non enzymatique
Elle est induite par une glycémie trop élevée. Elle correspond à l’interaction complexe d’un glucose et d’une protéine. Les protéines engagées dans cette réaction deviennent brunes et ont une durée de vie très longue. La glycation est impliquée dans la rigidification des vaisseaux sanguins, car elle durcit le collagène qui les constitue. Des glycations exagérées existent lors de diabète de type sucré. Il existe une analogie entre les effets du diabète et ceux du vieillissement18.
 Autres substances
Autres substances
D’autres substances sont aussi mises en cause, notamment la lipofuscine et les protéines du choc thermique.
– La lipofuscine. Elle provient des lysosomes cellulaires. Lorsque ces derniers vieillissent, ils ne peuvent plus se dégrader eux-mêmes du fait de la perte de leur activité enzymatique, ils deviennent alors des corps résiduels qui vont pouvoir résider très longtemps dans la cellule et former un dépôt. Cette substance entraverait le bon fonctionnement de la cellule et diminuerait ses capacités. Les neurones, le cœur et la peau des personnes âgées ne sont pas épargnées et contiennent des quantités particulièrement importantes de lipofuscine. Au niveau neuronal, la quantité de ces dépôts est proportionnelle à l’âge du neurone, ce qui s’explique par le fait que les cellules nerveuses ne sont pas renouvelées.
– Les protéines de choc thermique. En réponse à certaines agressions, l’organisme produit des protéines. Ces protéines de choc thermique protègent les mitochondries en cas de stress, d’agressions, de chocs thermiques ou en réponse aux glucocorticoïdes. Leur rôle est de rendre les cellules plus résistantes et de stimuler les systèmes de réparation cellulaire. Elles sont aussi appelées Heat Shock Protein ou HSP. Leur sécrétion et leurs effets diminuent avec le temps.
 Modifications du contexte hormonal
Modifications du contexte hormonal
Les modifications observées consistent en une baisse de production de certaines hormones qui ont un retentissement sur l’organisme et sont incriminées dans les effets du vieillissement, voire dans le processus dégénératif. Parmi elles, les œstrogènes sont responsables d’une perte osseuse et des modifications de la peau, l’hormone de croissance engendre le vieillissement cutané, osseux et musculaire, et la mélatonine (produite par l’épiphyse) est responsable de l’apparition de troubles du sommeil et de troubles cognitifs.
Les modifications du métabolisme glucidique et une insulino-résistance contribuent à augmenter la glycémie en situation postprandiale et de stress, cette dernière pouvant majorer les processus de glycation non enzymatique des protéines. L’insulino-résistance joue un rôle important dans le syndrome métabolique. En effet, l’insuline permet aux cellules d’absorber le glucose, contribuant ainsi à la régulation de la glycémie. Si les cellules deviennent insulino-résistantes, cela entraîne une malabsorption du glucose, malgré la présence de l’insuline. Le glucose se retrouve alors en trop grande concentration dans le sang, et en quantité insuffisante dans les cellules. Afin de maintenir un taux de glucose adapté, le pancréas produit toujours plus d’insuline. Avec le temps, le pancréas, fatigué, n’arrive plus à fournir ce surplus d’insuline. La glycémie reste alors en permanence élevée, ce qui finit par provoquer l’apparition du diabète.
 Prédispositions génétiques
Prédispositions génétiques
 Généralités
Généralités
Les facteurs génétiques influencent la capacité à se multiplier d’une cellule, ils sont donc fortement impliqués dans les processus dégénératifs. Les prédispositions génétiques sont de deux ordres et se traduisent par :
– la présence sur des chromosomes de gènes fortement représentés chez les patients atteints d’une même pathologie dégénérative ;
– la présence d’une mutation d’un ou plusieurs gènes entraînant la pathologie dégénérative.
Le facteur génétique en cause prédispose une famille de malades à être plus touchée que les autres familles de la population générale. Cependant, cette prédisposition est parfois associée à un facteur déclenchant, et c’est la rencontre des deux qui engendre le processus dégénératif.
Afin de comprendre les facteurs favorisant la survenue de pathologies dégénératives, les chercheurs explorent plusieurs pistes, dont la piste génétique. Elle consiste à rechercher soit des groupements de gènes plus fortement présents chez les groupes de patients que dans la population générale, soit à détecter des anomalies de type mutations19.
Une mutation peut survenir à tout moment dans n’importe quelle cellule de l’organisme. Elle peut être spontanée (résultant d’une erreur de recopiage de l’ADN car aucun système n’est parfait…) ou induite par des agents qualifiés de « mutagènes » qui peuvent être chimiques ou physiques (ex : les rayons ultraviolets ou les produits toxiques des cigarettes). L’organisme répare l’immense majorité des mutations mais parfois celle-ci échappe à la réparation et se « fixe » dans l’ADN. Une mutation ne sera transmissible que si elle est présente dans le matériel génétique transmis, dans ce cas, la descendance héritera de la mutation.
 Surreprésentation génétique
Surreprésentation génétique
La présence d’un ou de plusieurs gènes peut favoriser la survenue d’une pathologie dégénérative, cependant les mécanismes qui déclenchent ces pathologies ne sont pas encore connus. Actuellement, c’est la concordance entre la présence chez des groupes de patients présentant la même pathologie de certains gènes qui amènent les chercheurs à fortement suspecter leurs origines génétiques (entre autres étiologies).
Le diabète de type 1 ou diabète insulinodépendant (DID) est une forme de diabète sucré qui apparaît le plus souvent de manière brutale chez l’enfant ou chez le jeune adulte.
C’est une maladie auto-immune dans 90 % des cas qui provoque la destruction progressive des cellules β des îlots de Langerhans synthétisant normalement l’insuline. Ce mécanisme aboutit à une carence absolue en insuline, appelée l’insulinopénie. Le mécanisme de survenue reste inexpliqué dans 10 % des cas, on le nomme diabète de type 1 non auto-immun. Il existe des facteurs qui prédisposent une personne à développer un diabète de type 1, des facteurs génétiques, des infections virales, rubéole, CMV20, des facteurs diététiques comme l’introduction précoce du lait de vache dans l’alimentation des nouveau-nés…
Il apparaît de façon démontrée que des facteurs génétiques prédisposent le développement d’un diabète de type 1, cependant le déterminisme du diabète ne dépend pas d’un seul gène mais de plusieurs. La localisation dans le génome n’est pas encore précise, néanmoins deux régions ont été identifiées :
![]() En ce qui concerne le diabète de type 1, il a été retrouvé dans le système HLA21 (Human Leucocyte Antigen) des complexes protéiniques fortement représentés : il s’agit des allèles DR3 et/ou DR4, DQB1*0302, les sujets hétérozygotes DR3/DR4 ayant 50 fois plus de risques de développer un diabète que la population générale.
En ce qui concerne le diabète de type 1, il a été retrouvé dans le système HLA21 (Human Leucocyte Antigen) des complexes protéiniques fortement représentés : il s’agit des allèles DR3 et/ou DR4, DQB1*0302, les sujets hétérozygotes DR3/DR4 ayant 50 fois plus de risques de développer un diabète que la population générale.
21 En biologie, les antigènes des leucocytes sont le complexe majeur d’histocompatibilité (CMH) chez l’humain. Les antigènes des leucocytes humains sont des molécules à la surface des cellules qui permettent l’identification par le système immunitaire. Ces protéines sont nommées « molécules du CMH » (ou MHC en anglais).
Par opposition, il a aussi été prouvé que certains allèles sont plutôt protecteurs, et les sujets qui les portent ont moins de risque de développer un diabète de type 1 que la population générale.
Cependant, les facteurs génétiques ne sont pas suffisants pour expliquer le déclenchement du processus auto-immun, puisque seuls 50 % des jumeaux homozygotes développent eux aussi un diabète de type 1. C’est pourquoi on suspecte d’autres facteurs déclenchant ce processus auto-immun.
 Mutation(s) génétique(s)
Mutation(s) génétique(s)
Une mutation est une modification de la séquence de l’ADN, support chimique de l’information génétique présente dans chacune de nos cellules (cf. Biologie fondamentale, Elsevier-Masson, 2009). Il en existe plusieurs types : la substitution ou mutation ponctuelle, l’insertion, la délétion.
Les mutations peuvent ou non avoir des conséquences sur l’organisme, l’exemple suivant illustre parfaitement les conséquences d’une mutation génétique22.
![]() Pour garder l’analogie du « langage » de l’ADN, les mutations correspondent à des erreurs de frappe. Prenons la phrase suivante en français « j’utilise de la colle ». Différentes mutations possibles et leurs conséquences sont détaillées ci-dessous.
Pour garder l’analogie du « langage » de l’ADN, les mutations correspondent à des erreurs de frappe. Prenons la phrase suivante en français « j’utilise de la colle ». Différentes mutations possibles et leurs conséquences sont détaillées ci-dessous.
| Phrase | Type d’événement | Conséquence |
|---|---|---|
| J’utilise de la colle. | - | - |
| J’utilise de lalcolle. | Insertion d’un l | Changement de sens |
| J’utilise deula colle. | Insertion d’un u | Phrase compréhensible |
| J’uti sanglots de lise | Longue insertion | Phrase incompréhensible |
| J’utilise .. la colle. | Délétion | Phrase compréhensible |
| J’ut………..olle. | Délétion | Phrase incompréhensible |
| J’utilise de la Colle. | Mutation neutre | Sens inchangé |
| J’utiliss de la colle. | Mutation faux-sens | Phrase dure à comprendre |
| J’utilise de la kolle. | Mutation faux-sens | Phrase compréhensible |
| J’utilise de. | Mutation non-sens | Phrase tronquée, illisible |
On constate que, suivant le contexte et par le fait du hasard, certaines modifications peuvent laisser la phrase inchangée, modifier son sens, la rendre complexe à lire, incompréhensible ou tronquée donc illisible.
Il en va exactement de même pour l’effet des mutations dans l’ADN, les phrases correspondant à des protéines. Les mutations peuvent laisser ces dernières inchangées, les rendre moins actives ou inactives, leur conférer une fonction différente (potentiellement toxique), les rendre totalement inactives, les tronquer ou empêcher leur production.
Ainsi, les mutations génétiques aboutissent à la production de protéines modifiées, ces dernières n’ayant plus les propriétés initiales et nécessaires au bon fonctionnement de l’organisme.
• La dystrophie musculaire de Duchenne (MDM)23 est une pathologie neurodégénérative héréditaire liée au sexe. Les anomalies du gène MDM sont responsables d’une absence totale de production de dystrophine, protéine située sous la membrane plasmique de tous les types de myocytes (squelettiques, cardiaques et lisses), elle permet l’accrochage des filaments d’actine de la cellule musculaire à la laminine de la membrane basale.24 Le gène responsable de la dystrophie musculaire de Duchenne est porté par le chromosome X, et seuls les garçons en sont affectés. En l’absence de cette molécule, les enveloppes cellulaires et tissulaires des muscles sont fragilisées et les muscles s’abîment lorsqu’ils se contractent. La fragilité des cellules aboutit à leur destruction : on parle de dégénérescence. Celle-ci finit par entraîner une nécrose du tissu musculaire. Cette pathologie est transmise par la mère qui est porteuse de l’anomalie sans en éprouver de symptômes ou signes puisqu’elle est XmXM (m étant l’allèle porteur de l’anomalie et M l’allèle sain), et qu’un seul chromosome X est touché (Xm). La transmission du chromosome Xm à expression récessive associé au chromosome Y entraînera l’expression de la maladie.
• Le gène ApoE situé sur le chromosome 19 serait impliqué dans la maladie d’Alzheimer (MA) : la fréquence de l’allèle E4 est retrouvée dans 15 % de la population générale et dans 35 à 40 % chez les sujets atteints de MA.
• Dans les formes familiales autosomiques de la maladie d’Alzheimer, on identifie une mutation génétique : mutation des gènes APP (Amyeloid Protein Precursor), préséniline 1 et prénésiline 2.
 Traumatismes et/ou pathologies associés
Traumatismes et/ou pathologies associés
Certaines pathologies relevant d’autres processus peuvent être à l’origine d’une affection relevant du processus dégénératif. Parmi les plus fréquentes, notons les pathologies liées aux processus inflammatoire et infectieux et au processus traumatique. Dans ce cas, la pathologie antérieure est considérée comme constituant un facteur prédisposant au processus dégénératif.
 Traumatismes
Traumatismes
Un traumatisme peut entraîner des lésions articulaires de type dégénératif, il sera alors responsable de l’apparition d’une arthrose post-traumatique. En effet, les contraintes de pression au moment du traumatisme déclenchent une chondrolyse. Les lésions peuvent être immédiates par mort cellulaire chondrocytaire ou retardées par phénomène d’apoptose, qui est la mort cellulaire programmée25.
D’autres facteurs de risque sont souvent associés au traumatisme et favorisent la survenue de la lésion dégénérative : l’obésité, les causes d’hyperpression articulaire professionnelle ou personnelle (arthrose du coude provoquée par le marteau-piqueur, coxarthrose du sportif, gonarthrose du carreleur…).
 Pathologies infectieuses
Pathologies infectieuses
Qu’elles soient dues à des micro-organismes tels que bactéries, virus, parasites, champignons, ou à des prions, les pathologies infectieuses (ou parasitaires) peuvent être à l’origine d’un processus dégénératif.
Le prion est une protéine de très petite taille dont le rôle est de transmettre des messages entre les cellules. Pour des raisons encore inconnues, cette protéine peut connaître une modification de sa structure et devenir alors pathogène et résistante à l’action des enzymes. Elle s’accumule autour des cellules cérébrales provoquant l’apparition de cavités. Ces agents immunologiques peuvent être responsables d’une infection suite à une contamination. Un certain nombre d’entre eux est suspecté d’être à l’origine de pathologies dégénératives.
• L’encéphalopathie spongiforme bovine (ESB)26, appelée « maladie de la vache folle » ou en anglais Bovine Spongiform Encephalopathy (BSE), a été identifiée pour la première fois en Grande-Bretagne en 1985 et déclarée en 1986. Elle appartient au groupe des encéphalopathies spongiformes subaiguës transmissibles (ESST) connues chez d’autres espèces animales (chat, mouton, wapiti, vison) et correspond à une infection dégénérative du système nerveux central des bovins. Cette maladie mortelle est analogue à la tremblante des ovins et des caprins causée par des agents transmissibles non conventionnels (ATNC), c’est-à-dire ni virus ni bactérie. Ces agents sont des protéines appelées « prions pathogènes ».
Elle se manifeste par l’apparition de cavités dans les cellules nerveuses cérébrales (visibles au microscope) faisant ressembler le cerveau à une éponge (d’où le terme de « spongiforme »). L’ESB se caractérise par l’apparition de symptômes nerveux sur des animaux adultes qui conduisent progressivement (entre un et six mois) et inéluctablement vers la mort. La cause de l’ESB est vraisemblablement la mutation d’une protéine appelée prion, présente sous sa forme normale dans les cellules cérébrales, vers une forme anormale (appelée alors prion pathogène).
La transmission à l’homme s’effectue par voie digestive, l’infection est alimentaire, elle est responsable de la maladie de Creutzfeldt Jakob. Personne n’a aujourd’hui d’idée précise quant à la durée d’incubation de cette pathologie, mais des facteurs génétiques sembleraient être associés à son déclenchement. La cible du prion est le système nerveux, l’évolution de la maladie est fatale aussi chez l’être humain.
• L’endocardite infectieuse (processus infectieux) est une cause d’insuffisance valvulaire puis d’insuffisance cardiaque si cette dernière n’est pas prise en charge correctement (processus dégénératif).
• Les pathologies vasculaires qui altèrent la plasticité neuronale telle l’hypertension artérielle non soignée, anticipent probablement de plusieurs années l’arrivée de la maladie d’Alzheimer.
FACTEURS PRÉCIPITANTS
Parmi les facteurs précipitants, on distingue les facteurs environnementaux et les comportements à risque.
Les facteurs environnementaux sont fréquents et nombreux. On les retrouve principalement dans le milieu de vie et le milieu professionnel. Leurs actions délétères se réalisent principalement au travers d’inhalation, d’ingestion, de contacts. Les agents incriminés sont les solvants, les déchets (type piles), les pesticides, les herbicides, l’alimentation, les métaux lourds…
Quant aux comportements à risque, ils consistent principalement en l’exposition volontaire à des produits réputés nocifs pour la santé. Il en est ainsi de l’exposition aux rayonnements solaires, au bruit, au tabagisme, à l’alcool, à une alimentation inadéquate…
 Facteurs environnementaux
Facteurs environnementaux
Certains facteurs environnementaux peuvent se combiner à des comportements à risque (ex : exposition volontaire et excessive au soleil, au bruit, aux produits toxiques…). Quelle que soit l’origine de l’exposition (involontaire ou volontaire) et la classe de rattachement dans l’exposé présenté ci-après, il est important de retenir que dans les deux cas il existe des mesures de protection qui peuvent être mises en œuvre pour en limiter les effets délétères.
 Radiations
Radiations
Les radiations, qu’elles soient liées à l’exposition solaire (ou aux lampes à bronzer) ou thérapeutiques (comme lors d’une radiothérapie), favorisent la survenue de pathologies dégénératives. Cependant, elles sont aussi à l’origine de processus tumoraux.
Près de 5 % de l’énergie du soleil est émise sous forme de rayonnement ultraviolet (UV). Ces rayons UV sont classés selon leur longueur d’onde, on distingue : les UVA, UVB et UVC. Toutefois, en raison de l’absorption des UV par la couche d’ozone de l’atmosphère, 99 % de la lumière UV qui atteint la surface de la terre appartient à la gamme des UV-A. Les UV traversent l’atmosphère même par temps froid ou nuageux, et ils ne sont pas responsables de la sensation de chaleur procurée par le soleil qui est due aux infrarouges.
 Rayons ultraviolets (UV)27
Rayons ultraviolets (UV)27
– Les UVA représentent 95 % des rayons (longueur d’onde de 400 à 315 nm). Ils peuvent pénétrer dans les couches profondes de la peau. Ils sont dangereux pour les yeux des enfants dont le cristallin ne joue que partiellement son rôle de filtre (90 % des UVA atteignent la rétine chez le nourrisson et encore 60 % avant l’âge de 13 ans ; chez l’adulte de plus de 20 ans, le cristallin arrête les UVA presque à 100 %). Le rayonnement UV peut endommager les yeux. À court terme, il occasionne une inflammation temporaire et douloureuse de la couche superficielle de l’œil. À long terme, il peut augmenter le risque de développer plusieurs pathologies de l’œil, notamment la cataracte.
– Les UVB (longueur d’onde de 315 à 280 nm) sont dangereux à forte intensité pour les yeux. Ils peuvent causer le « flash du soudeur » ou une photokératite, car ils ne sont arrêtés qu’à 80 % par le cristallin de l’adulte. Chez l’enfant, la moitié des UVB atteint la rétine des nourrissons et 25 % avant l’âge de 10 ans. Les UVB sont responsables à court terme des coups de soleil.
– Les UVC (longueur d’onde de 280 à 200 nm) sont les plus nocifs. C’est en altitude que l’on peut les rencontrer mais normalement ils sont complètement filtrés par la couche d’ozone de l’atmosphère.
Le stress photo-oxydatif induit par les ultraviolets A et B conduit à la formation de radicaux libres. Sous l’effet de l’accumulation de radicaux libres, des modifications structurales complexes des protéines et des membranes cellulaires aboutissent à l’apparition de protéines « pathologiques ».
Les UV sont plus nombreux entre 12 heures et 16 heures et à haute altitude (car en traversant une plus petite distance dans l’atmosphère, ils sont moins bien interceptés par des molécules d’ozone). Les UV sont réfléchis par certaines substances à des degrés divers : 5 % par l’eau et l’herbe, 20 % par le sable, et 85 % par la neige. Dans la majorité des pays d’Europe, le soleil est le plus agressif entre 12 heures et 16 heures, c’est la raison pour laquelle il est déconseillé de s’exposer durant cette période notamment à proximité de l’eau ou de la neige.
Bien que les UV soient nocifs, le rayonnement UV est bénéfique et indispensable à la synthèse de vitamine D en petite quantité, mais aussi lors de certaines pathologies telles que le rachitisme, le psoriasis, l’eczéma… Invisibles, ils peuvent provoquer – sans que le sujet ne ressente de chaleur – des dommages sur les cellules, et entraîner à court terme des brûlures de la peau et des yeux. À long terme, ils sont responsables du vieillissement prématuré de la peau lorsque les expositions au soleil ont été fréquentes et/ou trop intenses. L’apparition de cancers cutanés comme le mélanome malin (processus tumoral), ainsi que les cataractes (processus dégénératif) sont les dangers auxquels s’exposent les passionnés du soleil… parfois 20 ans après leurs brûlures. Les ultraviolets sont nocifs pour la santé humaine et entraînent le bronzage. C’est d’ailleurs une des raisons d’exposition déraisonnée.
![]() On retrouve ce phénomène dans la perte de transparence du cristallin28.
On retrouve ce phénomène dans la perte de transparence du cristallin28.
 Bruit29
Bruit29
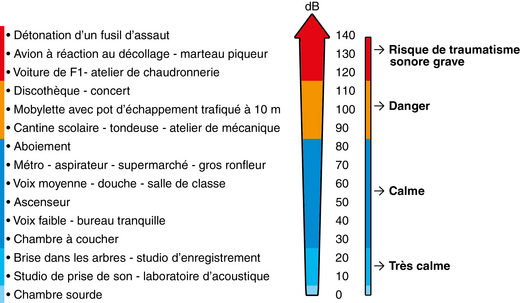
Les sons comme les bruits se caractérisent par leur intensité, leur fréquence et leur timbre.
L’intensité acoustique, encore appelée la force, est une grandeur liée au logarithme de l’amplitude qui se mesure en décibels (dB). L’oreille humaine perçoit les sons entre 20 et 120 dB. En deçà, les sons sont peu audibles ; au-delà, l’intensité est telle qu’elle provoque douleur et traumatisme des structures de l’oreille.
La hauteur du son (ou fréquence sonore) : l’oreille perçoit une gamme de sons de hauteurs ou tonies différentes, allant du plus grave au plus aigu. Leur perception dépend aussi de l’intensité à laquelle ces sons sont émis. Cette variable est exprimée en hertz (Hz), le seuil audible par un homme ayant une fonction auditive normale se situe entre 16 et 20 000 Hz, mais elle est fonction de l’intensité des sons émis.
Le timbre du son est comparable à une coloration du son. En effet, deux instruments de musiques différents qui émettent un son de même intensité et de même fréquence ne seront pas perçus à l’identique : leur timbre est différent.
L’exposition au bruit peut être à l’origine d’une dégénérescence des cellules sensorielles de l’oreille.
L’exposition à un bruit excessif crée un traumatisme sonore qui peut léser l’oreille interne et altérer la capacité auditive. Ce traumatisme peut être lié à l’utilisation professionnelle d’appareils bruyants, à une exposition à de la musique ou à d’autres bruits intenses, tels que tirs d’arme à feu ou déflagrations. Il peut être à l’origine d’une surdité qui sera reconnue comme maladie professionnelle, si elle survient dans le cadre de l’activité professionnelle.
La surexposition au bruit a des effets néfastes pour la fonction auditive.
 Les effets mécaniques
Les effets mécaniques
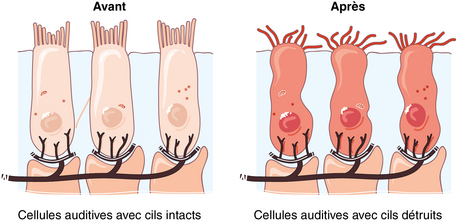
Lorsque l’oreille est exposée à des stimulations très élevées, les déplacements des cils vibratiles des cellules ciliées vont excéder la résistance mécanique des structures et conduire à leur destruction. On observe alors un désamarrage des cils de la membrane (figure 2.4).
 Les effets métaboliques
Les effets métaboliques
Les bruits peuvent agir sur le métabolisme des cellules sensorielles de l’organe de Corti ainsi qu’au niveau des synapses afférentes situées sous les cellules ciliées internes. Cette altération cellulaire est plus progressive, ce qui explique l’évolution du traumatisme sonore sur l’audition plusieurs heures voire plusieurs jours après l’exposition.
Attention : les cellules auditives détruites le sont définitivement. Elles ne se renouvellent pas.
 Les effets ioniques
Les effets ioniques
Les cellules baignent dans l’endolymphe qui est un liquide riche en ions (potassium, calcium). Celui-ci favorise le passage d’influx électriques permettant la mise en mouvement des cils. Le traumatisme sonore active les canaux calciques voltage-dépendants conduisant à l’entrée excessive de calcium. Ceci peut entraîner la formation de radicaux libres, éléments mis en cause dans les phénomènes d’apoptose.
 Les effets ischémiques et hypoxiques
Les effets ischémiques et hypoxiques
Un stimulus sonore important induit une vasoconstriction qui peut également s’observer dans la microcirculation cochléaire conduisant à une hypoperfusion de la cochlée. Ceci a été confirmé plus récemment par des chercheurs qui ont réussi à établir un lien de cause à effet entre la production de radicaux libres et la diminution du flux sanguin cochléaire. L’exposition à un bruit intense engendre donc la formation de radicaux libres, particulièrement dans les tissus associés aux vaisseaux cochléaires ; ces radicaux libres provoquent la formation d’éléments vasoconstricteurs cochléaires. La formation des radicaux libres et la diminution consécutive du flux sanguin cochléaire provoquent une ischémie qui induit à son tour la constitution de radicaux libres. Ainsi, ces derniers accélèrent et renforcent le processus dégénératif à l’origine de la surdité.
Les conséquences de cette surexposition au bruit sont une augmentation de la libération de radicaux libres et donc du phénomène apoptoïque, entraînant des lésions à moyen et long terme post-exposition.
 Les lésions des cellules auditives de l’oreille interne
Les lésions des cellules auditives de l’oreille interne
Le bruit a des effets sur l’organisme dès 75 dB. À ce stade, il provoque une élévation de la pression artérielle et de la fréquence cardiaque. La médecine du travail fixe à 85 dB le seuil de risque pour une exposition de 8 heures par jour. La norme internationale autorise une exposition à 105 dB, seulement 45 minutes par jour.
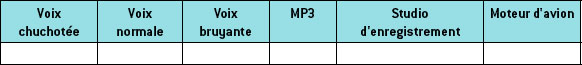
L’attention doit être portée sur le niveau sonore d’écoute de la musique, qu’il s’agisse d’une écoute individuelle par l’intermédiaire d’un baladeur audionumérique (type lecteur MP3) ou d’une activité collective en concert et/ou en discothèque (figure 2.5).
 Agents toxiques
Agents toxiques
L’exposition à des substances toxiques environnementales peut provoquer une accumulation de ces substances dans le cytoplasme cellulaire, accumulation délétère pour leur fonctionnalité et donc à l’origine de leur dégénérescence. L’étiologie des intoxications et intoxinations est très variée. Il peut s’agir d’une exposition à la pollution atmosphérique, exposition professionnelle, intoxication alimentaire, intoxication médicamenteuse, envenimation ou empoisonnement. Ces toxines se fixent sur différentes cellules, tissus et organes.
Certains toxiques affectent le cerveau ou le système nerveux, ils sont qualifiés de neurotoxiques ; d’autres ou les mêmes affecteront préférentiellement certains organes (glandes, poumons, foie, rein…).
Aujourd’hui, si certains métaux commencent à être incriminés dans de nombreux processus pathologiques, ils restent suspectés dans le processus dégénératif. Les études scientifiques sont menées pour faire le lien entre les taux d’agents chimiques et les pathologies, et les recommandations évoluent en santé publique suivant le principe de précaution pour éviter que les populations ne courent de risque. Les risques sont plus connus en ce qui concerne la survenue d’un processus tumoral.
La personne exposée à des produits toxiques (c’est-à-dire des substances agissant comme des poisons) qui peuvent pénétrer dans l’organisme par différentes voies va développer des processus pathologiques. L’exposition à des toxiques est responsable de perturbations qui peuvent être asymptomatiques dans l’immédiat ou responsables de signes cliniques visibles instantanément.
• L’exposition à des métaux lourds peut provoquer, à des doses importantes et durant un temps d’exposition long, des perturbations de la fonctionnalité de l’organisme. Il semble par exemple que l’exposition au plomb et au mercure soit un facteur suspecté dans la survenue de la maladie de Parkinson.
• Les agents chimiques, représentés notamment par les médicaments, peuvent être à l’origine de processus dégénératifs. Il s’agit d’iatrogénie médicamenteuse.
• La cataracte peut survenir consécutivement à la prise d’un médicament, c’est le cas de la corticothérapie au long cours, c’est-à-dire supérieure à un an.
L’utilisation de médicaments ototoxiques peut léser l’oreille interne à tout âge. On retrouve dans les différentes classes de médicaments près de 130 médicaments présentant une ototoxicité.
Il existe d’autres agents favorisant la survenue d’une pathologie dégénérative comme l’exposition au tabagisme. En effet, lorsqu’un organisme vit dans un environnement tabagique, il va épuiser sa capacité antioxydante et va se trouver plus tôt affecté de radicaux libres, éléments principaux expliquant les phénomènes de vieillissement.
 Surcharge pondérale et obésité
Surcharge pondérale et obésité
Il convient de distinguer le poids normal du surpoids et de l’obésité, et c’est grâce à l’indice de masse corporelle (IMC) que cette distinction peut être réalisée. La formule de l’IMC aujourd’hui considérée comme un standard s’applique à des adultes âgés d’au moins 18 ans pour distinguer les différentes formes de surpoids/obésité. Elle se calcule à partir de la formule suivante poids/taille2.
Les valeurs normales sont de 20 à 25 chez l’homme, et de 19 à 24 chez la femme. On parle de surpoids lorsque l’IMC est compris entre 28 et 30 pour les deux sexes. L’obésité concerne les personnes dont l’IMC est supérieur à 30. Elle est dite modérée lorsqu’elle est comprise entre 30 et 34,9 kg/m2, sévère entre 35 et 39,9 kg/m2 et morbide au-delà de 40 kg/m2. L’obésité et le surpoids sont le plus souvent liés à une mauvaise alimentation associée à un manque d’activité physique.
Surpoids/obésité (le plus souvent consécutifs à une alimentation riche en sucre et en graisse) et sédentarité provoquent une déficience insulino-sécrétoire secondaire à l’insulino-résistance. Celle-ci surexpose l’organisme à la formation de radicaux libres, pourvoyeurs d’accélération du processus du vieillissement. Or, nous avons vu précédemment que ces deux éléments participent au développement du processus dégénératif (cf. radicaux libres et stress oxydatif et insulino-résistance).
La surcharge pondérale agit aussi sur le système locomoteur car elle expose les articulations du squelette à des contraintes physiques anormales, notamment sur les articulations portantes. Elle favorise ainsi le développement de gonarthrose et de coxarthrose.
L’arthrose est déclenchée par une hyperpression (en lien avec l’obésité par exemple) sur le cartilage. Celle-ci a des conséquences majeures.
– Une réaction mécanique : le cartilage articulaire peut se fissurer progressivement jusqu’à disparaître totalement, laissant alors les os « à nu ». La surface du cartilage, qui est normalement régulière, se fissure et s’effrite, ce qui peut entraîner la disparition de segments complets de cartilage ;
– Une réaction biologique : les chondrocytes deviennent hyperactives, augmentant le métabolisme du cartilage, produisant à la fois du collagène et d’autres protéines pour essayer de réparer le tissu, mais aussi des enzymes de destruction. Ces cellules finissent par s’épuiser et mourir.
L’obésité30 et le surpoids qui concernent 41 % de nos concitoyens devraient devenir dans les prochaines années une cause importante d’insuffisance cardiaque. En effet, l’étude de Framingham démontre (après ajustement pour les autres facteurs de risque) que chaque augmentation de 1 point de l’index de masse corporelle entraîne une majoration du risque de développer une insuffisance cardiaque de 5 % chez l’homme et de 7 % chez la femme. Trois mécanismes physiopathologiques sont à l’origine des effets délétères de l’obésité sur la fonction ventriculaire gauche :
– l’augmentation de la pré-charge ventriculaire secondaire à la majoration du volume plasmatique induite par l’élévation de la masse graisseuse ;
– l’augmentation de la post-charge ventriculaire gauche due à l’association fréquente d’une hypertension artérielle à l’obésité. Celle-ci est générée par l’activation du système nerveux sympathique induite par l’hyperinsulinisme ;
– l’altération des fonctions systoliques et diastoliques, secondaire aux modifications myocardiques et à la maladie coronaire induite par les facteurs de risque d’athérosclérose (aggravés par l’obésité).
S’ENTRAÎNER
VÉRIFIER SES CONNAISSANCES
QCM
Surligner la ou les propositions exactes :
I. Un facteur prédisposant est en lien avec :
II. Un facteur précipitant est en lien avec :
III. Les mécanismes du vieillissement relèvent de :
1. Les conséquences et impacts d’un processus sont individuels V F
2. Les conséquences et impacts d’un processus sont individuels et collectifs V F
3. Les signes cliniques sont objectifs V F
4. Les signes cliniques sont subjectifs VF
5. Le vieillissement diminue les capacités de réserve V F
6. Au cours du vieillissement, les capacités de réserves de l’organisme sont sollicitées dans les situations habituelles V F
7. Les télomères sont des organites cellulaires V F
8. Les télomères sont impliqués dans le mécanisme du vieillissement V F
9. Une mutation génétique est une modification de la séquence d’ADN V F
10. Une mutation génétique a toujours des conséquences sur l’organisme V F
Préciser l’intensité correspondant aux situations proposées dans le tableau suivant.
CORRIGÉ
VÉRIFIER SES CONNAISSANCES
QROC
1. Le vieillissement est un processus physiologique concourant à l’ensemble des modifications physiologiques durables, survenant après la phase de maturité. Il est progressif, universel, inéluctable et irréversible, même s’il apparaît modulable par certains aspects actuellement.
Le vieillissement correspond à l’ensemble des processus physiologiques et psychologiques qui modifient la structure et les fonctions de l’organisme à partir de l’âge mûr. Il est la résultante des effets intriqués de facteurs génétiques (vieillissement intrinsèque) et de facteurs environnementaux auxquels est soumis l’organisme tout au long de sa vie. Il s’agit d’un processus lent et progressif qui doit être distingué des manifestations des maladies.
2. Le vieillissement s’accompagne d’un accroissement de certaines maladies du fait des effets cumulatifs du temps sur l’organisme. En effet, la durée d’exposition à certains facteurs de risque est plus longue et les modifications induites par le vieillissement favorisent l’apparition de certaines maladies.
3. Les radicaux libres, atomes ou molécules ayant un électron non apparié, sont fabriqués par les mitochondries lors de la production d’énergie. Cette production met en jeu de nombreuses réactions chimiques à partir d’oxygène et d’hydrogène. Les radicaux libres, avides d’électrons, vont en trouver au sein de molécules saines qu’ils « attaquent ». Cette attaque constitue le stress oxydatif.
4. Deux types de prédispositions génétiques :
Les radiations : les radiations solaires (ou aux lampes à bronzer) sont à l’origine d’un stress photo-oxydatif induit par les ultraviolets A et B. Ce stress oxydatif conduit à la formation de radicaux libres responsables de modifications structurales des protéines et des membranes cellulaires qui aboutissent à l’apparition de protéines « pathologiques ».
Le bruit : l’exposition au bruit peut être à l’origine d’une dégénérescence des cellules sensorielles de l’oreille. L’exposition à un bruit excessif crée un traumatisme sonore qui peut léser l’oreille interne et altérer la capacité auditive. La surexposition au bruit a des effets néfastes pour la fonction auditive d’un baladeur ou d’une activité collective en concert et/ou en discothèque.
Les agents toxiques : l’exposition à des substances toxiques environnementales (métaux lourds, produits chimiques, médicaments…) peut provoquer une accumulation de ces substances dans le cytoplasme cellulaire, accumulation délétère pour leur fonctionnalité et donc à l’origine de leur dégénérescence.
La surcharge pondérale, l’obésité (le plus souvent consécutifs à une alimentation riche en sucre et en graisse) et la sédentarité provoquent une déficience insulino-sécrétoire secondaire à l’insulino-résistance. Celle-ci surexpose l’organisme à la formation de radicaux libres, pourvoyeurs d’accélération du processus du vieillissement. La surcharge pondérale agit aussi sur le système locomoteur car elle expose les articulations du squelette à des contraintes physiques anormales, notamment sur les articulations portantes. Elle favorise ainsi le développement de gonarthrose et de coxarthrose.