Chapitre 10 Tumeurs épithéliales
 Savoir classer les différents types de tumeurs épithéliales en fonction de leur différenciation.
Savoir classer les différents types de tumeurs épithéliales en fonction de leur différenciation.
 Décrire les critères diagnostiques des tumeurs malpighiennes bénignes et malignes. Connaître les principales caractéristiques cliniques et morphologiques des carcinomes cutanés (épidermoïde et basocellulaire) et des carcinomes épidermoïdes dans leurs localisations extra-cutanées.
Décrire les critères diagnostiques des tumeurs malpighiennes bénignes et malignes. Connaître les principales caractéristiques cliniques et morphologiques des carcinomes cutanés (épidermoïde et basocellulaire) et des carcinomes épidermoïdes dans leurs localisations extra-cutanées.
 Connaître les critères diagnostiques macroscopiques et microscopiques des tumeurs épithéliales glandulaires bénignes et malignes. Identifier les aspects particuliers de ces tumeurs dans les organes pleins et les muqueuses (notamment l’exemple des tumeurs colorectales).
Connaître les critères diagnostiques macroscopiques et microscopiques des tumeurs épithéliales glandulaires bénignes et malignes. Identifier les aspects particuliers de ces tumeurs dans les organes pleins et les muqueuses (notamment l’exemple des tumeurs colorectales).
 Connaître les particularités diagnostiques et évolutives des tumeurs urothéliales et neuroendocrines.
Connaître les particularités diagnostiques et évolutives des tumeurs urothéliales et neuroendocrines.
Les tumeurs épithéliales peuvent être bénignes ou malignes, alors dénommées carcinomes. Elles sont développées à partir des épithéliums des revêtements (épiderme et muqueuses) ou à partir des épithéliums des organes pleins (parenchymes). Ces épithéliums peuvent être de trois types :
N.B. : nous traiterons à part le chapitre des tumeurs endocrines en raison des problèmes nosologiques qui leur sont propres.
Tumeurs malpighiennes
Les tumeurs malpighiennes, bénignes et malignes, sont très fréquentes et se développent surtout à partir des épithéliums malpighiens :
• muqueux : muqueuses malpighiennes du tube digestif (cavité buccale, pharynx, œsophage, canal anal) ou de l’appareil génital (figure 10.1).
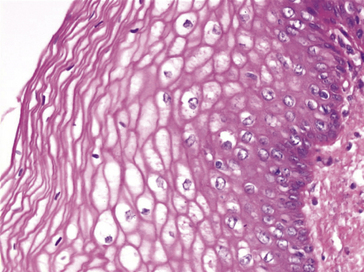
Figure 10.1 Épithélium malpighien normal : épithélium pavimenteux pluristratifié, ici non kératinisé (HES x20).
Plus rarement, elles peuvent siéger sur :
• les muqueuses paramalpighiennes (urothéliales) : voies excrétrices du rein, vessie, urètre ;
• les épithéliums glandulaires : elles constituent alors des tumeurs métaplasiques (qui ressemblent histologiquement à un épithélium différent de leur épithélium d’origine) ; l’exemple le plus courant est celui du carcinome épidermoïde des bronches.
Tumeurs bénignes malpighiennes
Papillomes
Le papillome est macroscopiquement une tumeur végétante, exophytique, souvent framboisée sur les muqueuses, en saillie sur le plan du revêtement malpighien qui lui donne naissance. Il peut siéger sur la peau (ex : verrue vulgaire) ou sur les muqueuses. Il est fréquemment d’origine virale, lié à un virus du groupe HPV (Human Papilloma Virus) (figures 10.2, 10.3).
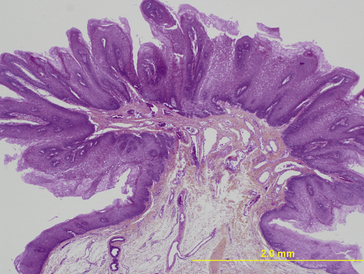
Figure 10.3 Papillome (aspect microscopique) : hyperplasie épithéliale, hyperacanthose, papillomatose, hyperkératose (HES x20).
Sur le plan histologique, trois critères sont requis pour le diagnostic :
1. la papillomatose : les crêtes épidermiques (ou épithéliales) sont allongées, la couche basale de l’épithélium est très sinueuse ;
2. l’hyperacanthose : l’épithélium malpighien est épaissi au niveau du corps muqueux de Malpighi (couche des cellules épineuses) ;
3. l’hyperkératose : la couche de kératine est épaissie (dans l’épiderme). On dira hyperkératose orthokératosique en cas de squames anucléées (orthokératose) et parakératosique si les squames ont conservé des noyaux pycnotiques (parakératose).
Il s’agit d’une tumeur bénigne : l’architecture générale de l’épithélium est préservée, l’intégrité de la membrane basale est partout respectée, il n’y a pas d’atypie cytonucléaire franche, mais les mitoses sont plus nombreuses que normalement. La différenciation malpighienne et la maturation kératosique restent normales ou voisines de la normale dans toute l’épaisseur de la prolifération épithéliale.
Condylome
Il siège sur les muqueuses malpighiennes et est également lié au virus HPV. Le mode de transmission est ici essentiellement sexuel. Il se développe principalement au niveau de l’exocol utérin, du vagin, de la vulve, de la zone ano-rectale et du pénis, plus rarement au niveau pharyngo-laryngé (mode de contamination possible chez le nouveau-né lors du passage de la filière génitale).
Macroscopiquement, les condylomes peuvent être acuminés (en chou-fleur ou en crête-de-coq), ou plans.
Microscopiquement : à la prolifération épithéliale malpighienne plus ou moins intense, peut s’associer une augmentation de volume du tissu conjonctif sous-jacent (qui peut être plus importante que la prolifération épithéliale) et des aspects cytopathogènes en rapport avec l’infection virale (figure 10.4).
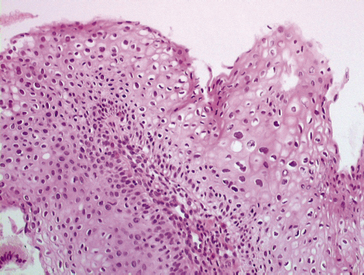
Figure 10.4 Condylome (aspect microscopique) : hyperkératose, papillomatose, aspects cytopathogènes d’une infection HPV : halos clairs périnucléaires, cellules multi nucléées.
Les papillomes et les condylomes sont parfois multiples : papillomatose (laryngée, fosses nasales), condylomatose (génitale).
Évolution
Ces tumeurs sont bénignes et ne récidivent pas après exérèse. Certaines cependant constituent des états précancéreux et peuvent évoluer vers un carcinome épidermoïde (avec souvent une phase de carcinome in situ préalable) : c’est en particulier le cas des condylomes plans génitaux, qui sont à l’origine de la presque totalité des cancers du col utérin, et beaucoup plus rarement de certaines papillomatoses des voies aériennes supérieures.
Carcinomes des revêtements malpighiens (peau et muqueuses)
Hormis le carcinome basocellulaire qui n’est observé qu’au niveau cutané, tous les autres sont des carcinomes épidermoïdes, qui partagent les mêmes critères diagnostiques histopathologiques :
• la présence de signes architecturaux et cytologiques classiques de malignité ;
• une différenciation malpighienne variable, permettant de distinguer :
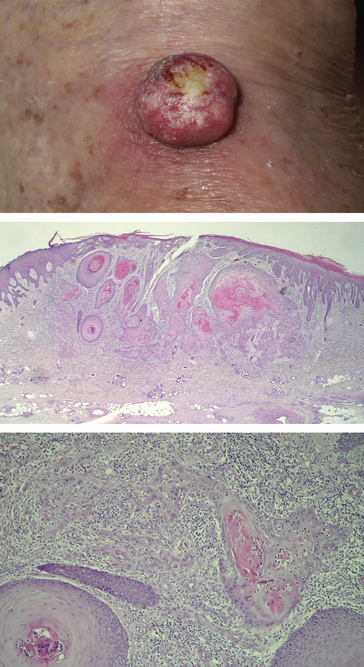
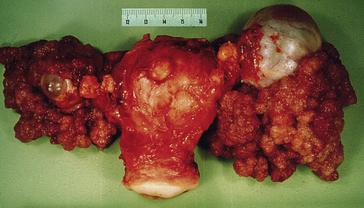
Figure 10.5 Carcinome épidermoïde. En haut : aspect macroscopique. Milieu : faible grandissement microscopique. Tumeur cutanée formant des massifs épithéliaux cohésifs infiltrant profondément le derme. Dès ce grandissement, la différenciation malpighienne est évidente, avec une maturation vers le centre des massifs avec élaboration de kératine, mieux visible au fort grandissement (en bas).
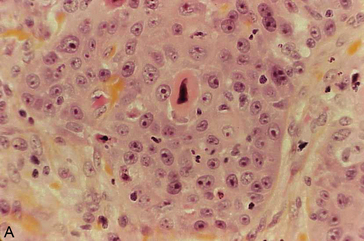
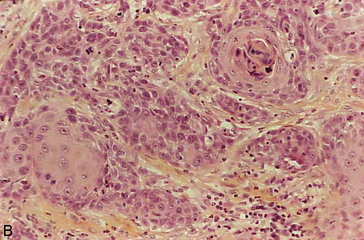
Figure 10.6 La kératinisation au sein d’un carcinome épidermoïde peut se produire : A. Au sein de cellules isolées dont le cytoplasme devient très acidophile et le noyau pycnotique (kératinisation monocellulaire) ; B. Au centre d’un massif tumoral, formant un amas éosinophile appelé « globe corné », contenant ou non des noyaux pycnotiques.
Carcinomes cutanés
Il s’agit de tumeurs très fréquentes. Elles sont de diagnostic précoce (lésions visibles, prélèvements faciles). On distingue deux grands types très différents sur le plan clinique et histologique :
1. les carcinomes épidermoïdes (anciennement dénommés carcinomes spinocellulaires) ;
2. les carcinomes basocellulaires, qui sont limités à la peau.
Le facteur de risque principal est l’exposition prolongée au soleil. Ces carcinomes touchent surtout les adultes de race blanche, principalement dans les régions découvertes, exposées au soleil (visage, oreilles, nuque, dos des mains). Le carcinome basocellulaire touche des personnes souvent plus âgées que le carcinome spinocellulaire, avec une localisation préférentielle sur le visage.
Plusieurs lésions précancéreuses sont connues : kératose solaire (ou sénile), radiodermite, cicatrice de brûlure, ulcères cutanés chroniques (les trois derniers pour le carcinome épidermoïde uniquement).
Une condition génétique, le xeroderma pigmentosum favorise l’apparition précoce de multiples tumeurs cutanées.
Carcinomes épidermoïdes cutanés
Macroscopie : la tumeur est le plus souvent ulcéro-végétante, plus ou moins infiltrante (figure 10.7A-B).
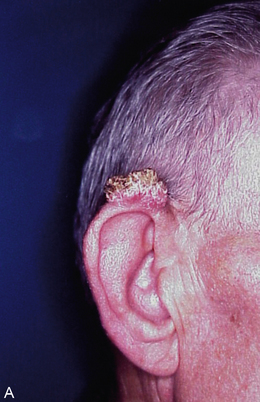
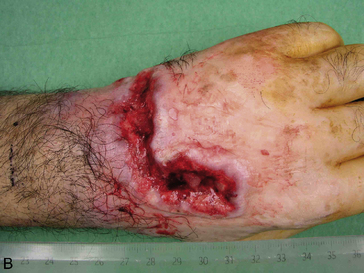
Figure 10.7 Macroscopie des carcinomes épidermoïdes cutanés. A. Tumeur bourgeonnante et kératosique de l’oreille. B. Tumeur ulcérée de l’avant-bras, très évoluée (noter la présence d’un bourrelet tumoral périphérique entourant l’ulcération).
Histopathologie : le carcinome épidermoïde (ou malpighien) peut être plus ou moins bien différencié : la tumeur reproduit plus ou moins parfaitement la structure d’un épithélium malpighien kératinisé (voir ci-dessus).
Évolution : l’extension tumorale est surtout locale. Les métastases ganglionnaires sont tardives et les métastases viscérales sont exceptionnelles.
Carcinomes basocellulaires
Macroscopie : la tumeur est souvent ulcérée, entourée de petites surélévations (perles). Plus rarement, elle est de forme plane, « cicatricielle ».
Histopathologie : les cellules ressemblent aux cellules basales de l’épiderme (d’où la dénomination de la tumeur) et sont rangées en lobules. Classiquement, il n’y a pas de différenciation épidermoïde, ni de maturation cornée (figure 10.8).
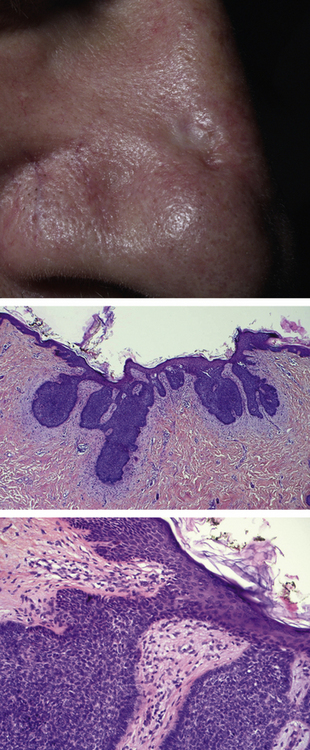
Figure 10.8 Carcinome basocellulaire de l’aile du nez (en haut). L’histologie (centre et en bas), à deux grossissements différents, révèle des amas de cellules de petite taille (de type basal) appendus à l’épiderme et entourés d’un stroma fibreux.
Évolution : elle est purement locale et lente. Le carcinome basocellulaire ne donne jamais de métastases (« malignité locale »). En revanche, il peut avoir une extension locale très importante (envahissement parfois profond, pouvant atteindre les structures osseuses sous-jacentes) et donner des ulcérations étendues (porte d’entrée de germes) ou quelquefois des hémorragies. Guérison si l’exérèse est complète, sinon récidive locale.
Carcinomes épidermoïdes des muqueuses
L’aspect histopathologique est identique à celui des carcinomes épidermoïdes cutanés, avec des degrés de différenciation et de maturation variables.
Les facteurs de risque et l’aspect macroscopique varient selon les organes touchés.
Voies aéro-digestives supérieures (pharynx, larynx, cavité buccale)
Facteurs de risque : tabac, alcool et surtout association des deux, mauvais état bucco-dentaire, existence de lésions précancéreuses (leucoplasie, dysplasie).
Macroscopie : tumeurs végétantes et infiltrantes, fréquemment associées à de la dysplasie, souvent plurifocales.
Évolution : métastases ganglionnaires puis viscérales. Association possible à un carcinome épidermoïde bronchique (à rechercher systématiquement).
Bronches
Il s’agit d’un carcinome métaplasique : en effet, ce carcinome épidermoïde survient sur un épithélium de type glandulaire (pseudostratifié cilié) ayant subi une métaplasie malpighienne, le plus souvent sous l’effet du tabagisme.
Facteur de risque majeur : tabac.
Macroscopie : aspect surtout végétant dans les grosses bronches, avec destruction du parenchyme pulmonaire et nécrose de certains territoires tumoraux (figures 10.9 et 10.10A-B). Parfois la nécrose est telle qu’il peut y avoir un aspect excavé, cavitaire (diagnostic différentiel avec la tuberculose ou avec un abcès).
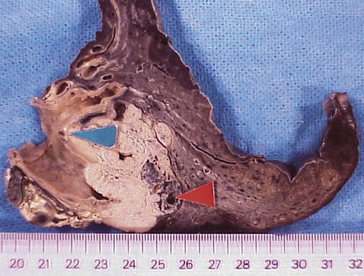
Figure 10.9 Tumeur bronchique proximale réalisant une obstruction bronchique complète ; flèche bleue : bifurcation bronchique ; flèche rouge : envahissement par contiguïté d’un ganglion anthracosique.
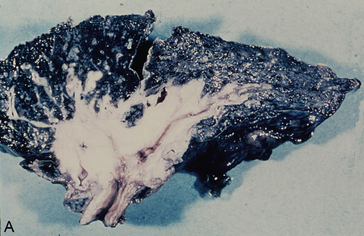
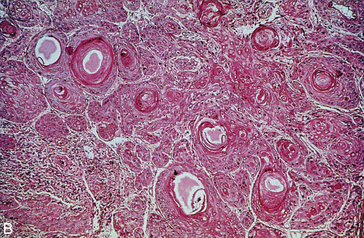
Figure 10.10 Carcinome épidermoïde bronchopulmonaire. A. Macroscopie. B. Microscopie : noter ici la présence de nombreux globes cornés (carcinome épidermoïde bien différencié et kératinisant).
Évolution : le carcinome épidermoïde bronchique est souvent découvert à un stade avancé, d’emblée inopérable. Les métastases siègent dans les ganglions lymphatiques, le foie, les os, la glande surrénale, le cerveau, le reste du parenchyme pulmonaire. Le pronostic est en général mauvais.
Col utérin
Facteurs de risque : infection à HPV et condylome (facteur de risque majeur/intérêt de la vaccination), tabac.
Macroscopie : la tumeur est souvent ulcéro-infiltrante et végétante, avec parfois un aspect hypertrophique du col utérin.
Évolution : métastases ganglionnaires, métastases à distance. Le pronostic dépend principalement de la précocité du diagnostic, d’où l’intérêt du dépistage par le frottis cervico-vaginal.
Tumeurs glandulaires
Ce sont des tumeurs fréquentes, bénignes (adénomes) ou malignes (adénocarcinomes). Elles intéressent les organes creux ou les parenchymes glandulaires. Leurs aspects macroscopiques et histologiques varient selon le type d’organe qu’elles touchent. Elles reproduisent morphologiquement des structures glandulaires, avec un degré de différenciation plus ou moins important (figure 10.11).
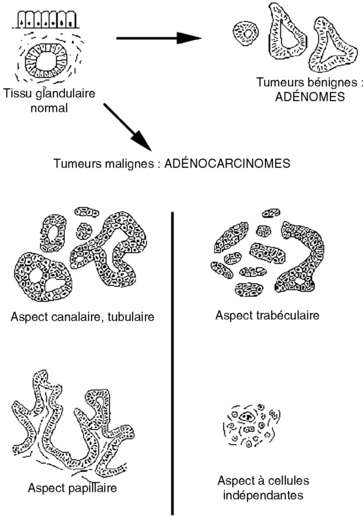
Figure 10.11 Schéma de la différenciation des tumeurs glandulaires bénignes (adénomes) et malignes (adénocarcinomes).
Les tumeurs bénignes à différenciation glandulaire ou adénomes ont en commun d’être constituées, en général, de formations très différenciées, proches du tissu normal.
Les tumeurs malignes à différenciation glandulaire ou adénocarcinomes ont un degré de différenciation variable : un adénocarcinome peut être : bien différencié, moyennement différencié, peu différencié ou encore métaplasique.
• Bien ou moyennement différencié : quand la prolifération rappelle le tissu d’origine : architecture glandulaire persistante bien que pathologique, aspect sécrétoire.
• Peu différencié : quand les caractères glandulaires sont moins nets ou absents à l’examen histologique standard. Dans ce cas, des caractères de différenciation peuvent être mis en évidence par des colorations histochimiques (présence de mucus) (figure 10.12), et des techniques immunohistochimiques. (Exemples : expression de l’antigène prostatique spécifique (PSA) dans les cancers de la prostate, de TTF-1 (Thyroid transcription factor-1) pour un cancer du poumon ; profil d’expression particulier des cytokératines pour les tumeurs digestives, ovariennes…)
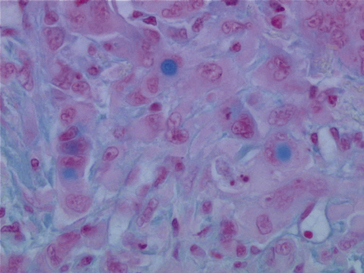
Figure 10.12 Adénocarcinome peu différencié mucosécrétant : la coloration par le bleu Alcian met en évidence des vacuoles de mucus intracellulaires.
Autrefois, la microscopie électronique apportait beaucoup d’informations sur la différenciation des tumeurs. Elle est aujourd’hui supplantée dans cette indication par l’immunohistochimie.
N.B. : on ne parle pas de maturation pour les adénocarcinomes (ne s’applique qu’à la formation de kératine, dans les carcinomes épidermoïdes).
• Métaplasique : quand la prolifération présente des caractères de différenciation habituellement rencontrés dans des tumeurs d’autre origine : adénocarcinome lieberkühnien (c’est-à-dire de type colique) développé dans l’estomac, adénocarcinome de l’œsophage (sur endobrachyœsophage).
Nous prendrons dans les différentes catégories d’adénocarcinomes, des exemples particuliers, afin d’illustrer des cadres pathologiques différents.
Tumeurs des organes creux
Ce sont les tumeurs des muqueuses digestives (estomac, côlon et rectum [figure 10.13], beaucoup plus rarement grêle), des muqueuses utérines (endomètre, plus rarement endocol), des voies biliaires et pancréatiques, des bronches…
Aspects macroscopiques communs
Les tumeurs bénignes (adénomes) font saillie dans la lumière de l’organe creux et prennent l’aspect d’un polype soit attaché à la muqueuse par un axe conjonctif (= polype pédiculé, figure 10.14), soit implanté directement sur la muqueuse (= polype sessile). Leur taille est variable : quelques millimètres à plusieurs centimètres.
Les tumeurs malignes (adénocarcinomes) prennent trois aspects principaux, bourgeonnant, ulcéré et infiltrant, souvent associés :
1. la forme débutante est souvent purement bourgeonnante ;
2. les tumeurs plus volumineuses associent une ulcération centrale, une zone bourgeonnante périphérique, une infiltration pariétale sous-jacente (figure 10.15) ;
3. certaines tumeurs sont purement infiltrantes, comme la linite gastrique.
D’autres ont, en coupe, une consistance gélatineuse, rappelant la colle, due à une abondante sécrétion de mucus. On les appelle carcinome colloïde muqueux ou carcinome mucineux.
Tumeurs colorectales
Facteurs de risque : alimentation riche en graisses animales et pauvre en fibres, maladie inflammatoire chronique du tube digestif, prédisposition génétique (syndrome de Lynch, polypose adénomateuse rectocolique familiale…).
Adénomes colorectaux
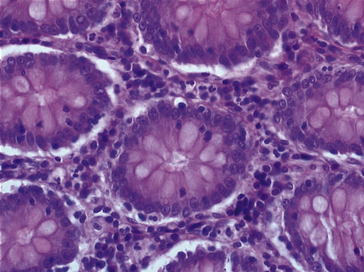
La prolifération cellulaire adénomateuse reste strictement intramuqueuse et est toujours limitée par une membrane basale. Les cellules épithéliales qui forment ces adénomes présentent des anomalies morphologiques qui traduisent des anomalies de leur génome : anomalies dysplasiques (voir chapitre 9, « Histoire naturelle du cancer »). Par rapport à des cellules intestinales normales, elles ont des cytoplasmes plus basophiles, sécrètent moins de mucus, ont des noyaux plus gros à chromatine plus dense et qui peuvent se chevaucher, et les mitoses sont plus nombreuses.
Il existe trois variétés histologiques d’adénomes colorectaux, définies selon l’architecture générale de la tumeur :
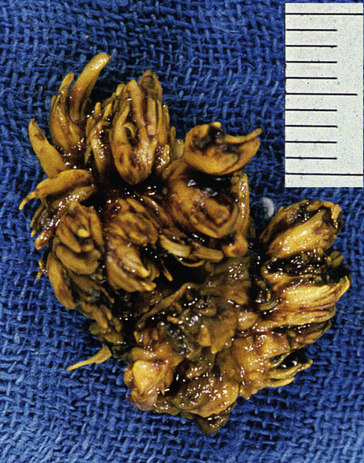
1. adénomes tubuleux : s’observent le plus souvent sur le rectosigmoïde avec une fréquence maximale entre 50 et 60 ans ; ils réalisent un polype (formation en saillie sur la muqueuse, arrondie ou polylobée), pédiculé (figure 10.16A-B) ou sessile (figure 10.16C) ; ils sont constitués de glandes coliques (glandes de Lieberkühn) (figure 10.16D) ;
2. adénomes villeux (plus rares) : ils forment des masses sessiles ou polypoïdes, molles, recouvertes de mucus, et constituées de fines digitations ; les récidives après exérèse sont fréquentes ;
3. adénomes tubulo-villeux : associent les deux aspects précédents.
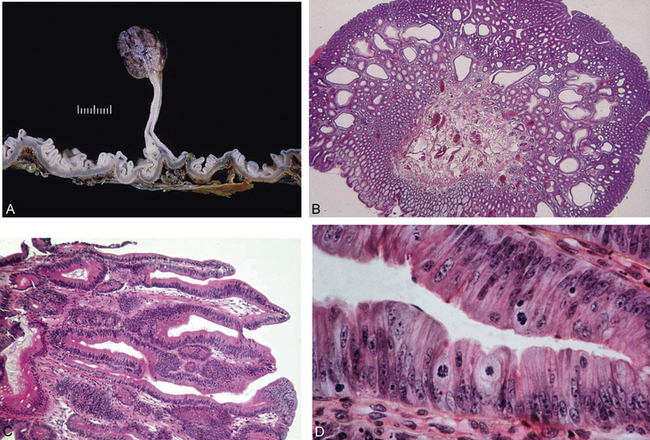
Figure 10.16 A. Aspect macroscopique d’un polype adénomateux du côlon (pédiculé). B. Adénome tubuleux aspect microscopique. C. Adénome villeux aspect microscopique. D. Dysplasie dans un adénome : aspect dédifférencié (perte de la polarisation cellulaire, anisocaryose, basophilie).
Dans tous les adénomes colorectaux, quelle que soit leur structure, il existe des modifications cellulaires et architecturales qui permettent de les classer comme des lésions précancéreuses (lésions dysplasiques).
Adénocarcinomes colorectaux
L’adénocarcinome du côlon et du rectum est un cancer très fréquent (la seconde cause de décès par cancer), observé à un âge moyen de 60 à 65 ans. Il siège le plus souvent (66 %) sur le rectosigmoïde, plus rarement sur le côlon gauche, le caecum ou le côlon transverse. Il se traduit cliniquement par des troubles du transit et des hémorragies.
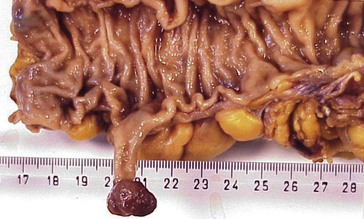
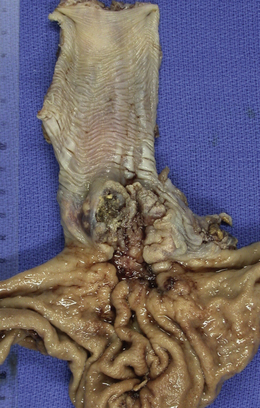
Macroscopie : la tumeur est le plus souvent ulcérée à sa partie centrale, avec un bourgeonnement plus ou moins marqué en périphérie et une infiltration pariétale qui s’étend vers la séreuse. Elle peut être circonférentielle, sténosante (figure 10.17A-B).
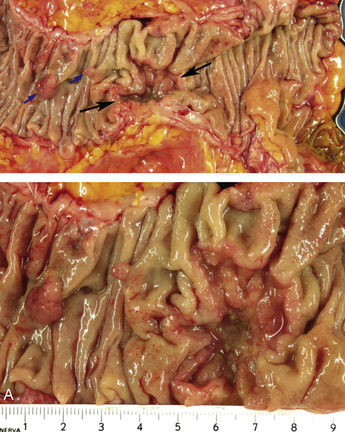
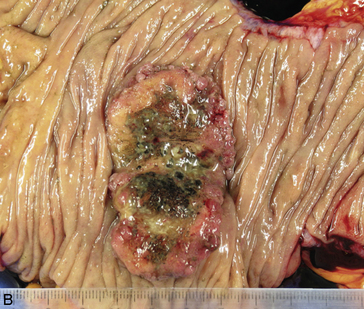
Figure 10.17 Aspects macroscopiques des adénocarcinomes coliques. A. Tumeur du caecum (flèches noires), associée à deux polypes de la muqueuse (flèches bleues). En bas, à un plus fort grossissement, la tumeur est ulcérante et infiltrante. B. Tumeur du côlon descendant avec un aspect bourgeonnant, mais sans obstruction.
Microscopie : en règle générale, l’adénocarcinome colorectal réalise une prolifération tumorale bien ou moyennement différenciée, de structure glandulaire rappelant la muqueuse colique et est dénommé adénocarcinome lieberkühnien (figure 10.18A). Dans certains cas, il existe une mucosecrétion très abondante, dissociant les formations carcinomateuses et le stroma : la tumeur prend alors le nom de carcinome colloïde muqueux (figure 10.18B) (ou carcinome mucineux). Plus rarement, la tumeur est peu différenciée, formée de cellules tumorales mucosecrétantes isolées les unes des autres : cellules en « bague à chaton» (figure 10.18C-D).
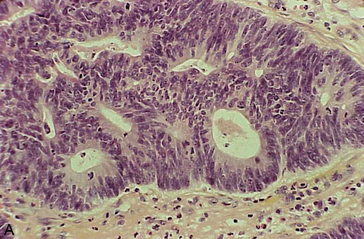
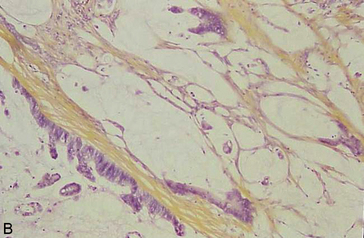
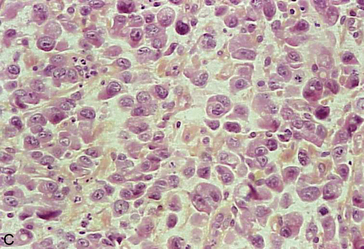
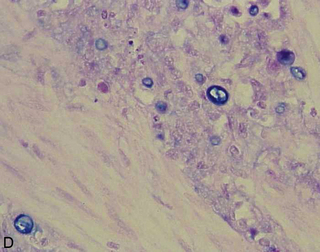
Figure 10.18 Aspects microscopiques des adénocarcinomes du côlon. A. Adénocarcinome lieberkühnien moyennement différencié : massif tumoral d’aspect polyadénoïde. B. Adénocarcinome mucineux : présence de grandes plages de mucus bordées par des cellules adénocarcinomateuses. C. Adénocarcinome peu différencié, à cellules indépendantes en « bague à chaton » ; les cellules indépendantes contiennent des vacuoles de mucus visibles sur la coloration par le bleu Alcian (D).
Évolution : l’extension tumorale est centrifuge, traversant progressivement les différentes tuniques pariétales du côlon vers la séreuse, avec souvent une invasion lymphatique. Les métastases les plus fréquentes sont ganglionnaires et hépatiques. Le stade TNM est basé sur le degré d’envahissement de la paroi colique et l’atteinte métastatique.
Relations adénome - cancer
Dans le côlon, il existe une véritable filiation entre tumeur bénigne (adénome) et tumeur maligne (adénocarcinome). Dix à quinze pour cent des adénomes sont susceptibles de cancérisation et l’on considère que la grande majorité des adénocarcinomes coliques dérive d’un polype adénomateux. Plus le polype est gros, plus il y a de risque qu’il soit cancérisé, mais c’est seulement l’étude microscopique qui déterminera si un polype est un adénome ou si l’adénome s’est transformé en cancer.
N.B. : l’évolution des adénomes vers la malignité est donc fréquente dans la muqueuse colique, mais ce n’est pas une règle générale applicable à toutes les tumeurs bénignes, glandulaires ou non.
(Voir aussi chapitre 9, « Histoire naturelle du cancer »)
La polypose adénomateuse colique familiale est une adénomatose caractérisée par le développement progressif de très nombreux adénomes rectocoliques, avec une évolution inéluctable vers l’apparition d’un ou plusieurs adénocarcinomes coliques. Elle est en rapport avec une mutation du gène APC.
Tumeurs des parenchymes glandulaires exocrines
Ce sont des tumeurs développées dans des organes pleins : seins, glandes annexes du tube digestif (foie, pancréas, glandes salivaires), ovaires, prostate, reins…
À noter que le foie, le pancréas, les ovaires sont également le siège de tumeurs développées aux dépens de leur contingent glandulaire endocrine (traitées plus loin).
Aspects macroscopiques communs
Les adénomes (tumeurs bénignes) des parenchymes glandulaires se présentent habituellement sous la forme d’un nodule : masse unique, régulièrement arrondie, encapsulée. Ce nodule est généralement homogène, de même consistance et de même coloration que le tissu normal voisin qu’il repousse et déforme (figure 10.19A). Les adénomes peuvent être kystiques (cystadénome) (figure 10.19B et C).
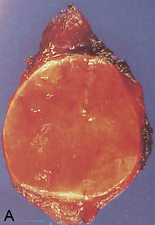
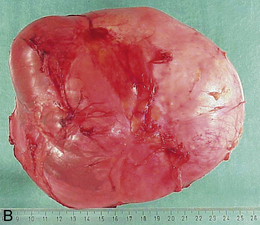
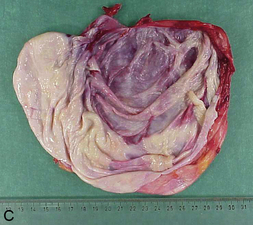
Figure 10.19 A. Adénome thyroïdien : nodule charnu, homogène, encapsulé, cerné par le tissu thyroïdien normal qui est refoulé en périphérie. B et C. Cystadénome ovarien : tumeur entièrement kystique, avant (b) et après (c) ouverture.
Les adénocarcinomes (tumeurs malignes) des parenchymes glandulaires sont de forme irrégulière, mal limités, envoyant des prolongements dans le tissu sain (forme étoilée), de consistance souvent dure. Ils peuvent être nodulaires, uniques ou multiples, fréquemment remaniés par des phénomènes nécrotiques (pouvant réaliser des pseudo-kystes) et hémorragiques leur conférant un aspect hétérogène à la coupe. La consistance est généralement ferme, sauf en cas de nécrose. Une forme particulière par sa dureté et son caractère rétractile, dus à l’existence d’un stroma fibreux abondant, est dénommée squirrhe. Ils peuvent aussi être kystiques (cystadénocarcinome), principalement au niveau de l’ovaire, mais comportent souvent des zones végétantes en plus des secteurs kystiques (figure 10.20).
Tumeurs mammaires
Tumeurs bénignes : adénofibromes
Au niveau de la glande mammaire, la prolifération adénomateuse est associée à un développement du tissu conjonctif réalisant une tumeur à double composante, glandulaire et conjonctive. On retrouve également cela dans la glande prostatique.
• Présentation clinique : l’adénofibrome survient chez la femme jeune. Il s’agit d’une tumeur arrondie, ferme et mobile.
• Macroscopiquement, il forme un nodule rond, dur, encapsulé (figure 10.21A).
• Microscopiquement, c’est une prolifération des galactophores : canaux à double assise cellulaire cylindrique interne et myoépithéliale externe. Les canaux sont refoulés en fentes étirées par la prolifération du tissu conjonctif (figure 10.21B).
• Pronostic : l’adénofibrome ne récidive pas si l’exérèse a été complète.
Tumeurs malignes : adénocarcinomes
Une femme sur 10 sera atteinte d’un cancer du sein pendant sa vie.
N.B. : il n’y pas de filiation entre adénofibrome et cancer du sein. Les lésions précancéreuses du sein sont des lésions épithéliales de type hyperplasique et dysplasique.
• Présentation clinique : les adénocarcinomes du sein surviennent avec un maximum de fréquence chez la femme après 50 ans, mais parfois avant 35 ans. La localisation la plus fréquente est le quadrant supéro-externe du sein, puis la région rétro-mamelonnaire. La tumeur est soit de découverte clinique : masse palpable de la glande mammaire, dure, parfois fixée ; ou plus souvent depuis la généralisation du dépistage, de découverte mammographique, devant un foyer de microcalcifications.
• Macroscopiquement, il s’agit le plus souvent d’un nodule tumoral stellaire, éventuellement adhérent, avec rétraction du mamelon quand il est proche (figure 10.22A).
• Microscopiquement, la prolifération adénocarcinomateuse est plus ou moins bien différenciée (figure 10.22B). Il faudra rechercher la présence d’emboles vasculaires sanguins ou lymphatiques. La prolifération carcinomateuse peut rester limitée aux canaux : on parle alors de carcinome in situ.
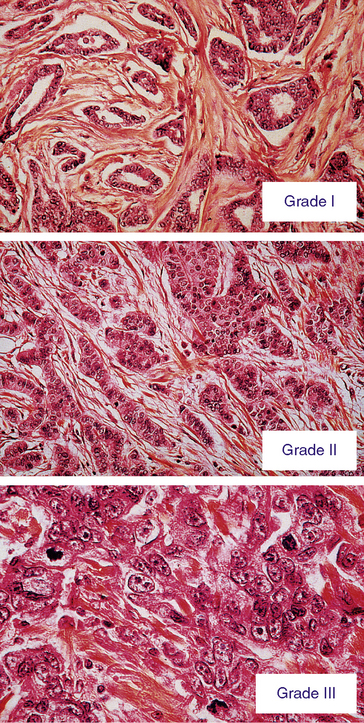
• Pronostic : le pathologiste intervient en évaluant le grade histopronostique de Scarff, Bloom et Richardson (SBR), qui prend en compte le degré de différenciation glandulaire, l’importance des anomalies cytonucléaires et le nombre de mitoses (figure 10.23). Il évalue également le stade d’extension (pTNM).
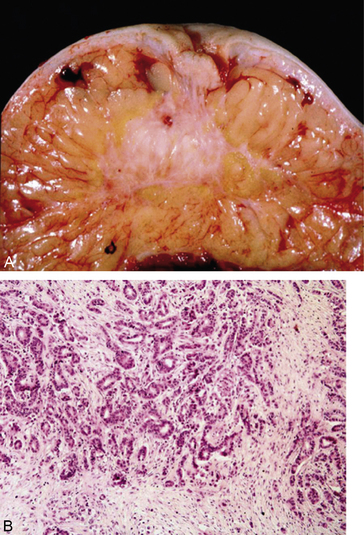
Figure 10.22 Adénocarcinome mammaire. A. Aspect macroscopique : tumeur stellaire avec de rétraction cutanée. B. Aspect microscopique : glandes mammaires tumorales irrégulières.
Voir aussi le complément en ligne En savoir plus 10.1 ![]() : « Tumeurs kystiques ovariennes ».
: « Tumeurs kystiques ovariennes ».
En savoir plus 10.1
Tumeurs kystiques ovariennes
Dans l’ovaire, certaines tumeurs kystiques sont des cystadénomes tout à fait bénins, avec un revêtement interne fait de cellules épithéliales ressemblant à des cellules séreuses ou mucineuses normales.
D’autres tumeurs kystiques ovariennes peuvent présenter une prolifération épithéliale plus intense : celle-ci forme en bordure de la cavité kystique des zones plus épaisses et végétantes (souvent détectables par l’échographie), et présente microscopiquement des anomalies cytologiques plus marquées : ces tumeurs sont appelées borderline : le terme anglais borderline signifie « tumeurs à la limite de la malignité » ou « à malignité atténuée ». Leur pronostic est intermédiaire entre l’excellent pronostic des cystadénomes bénins (curables par l’exérèse chirurgicale simple) et le pronostic péjoratif des carcinomes de l’ovaire.
Tumeurs des glandes endocrines
Il s’agit des tumeurs développées dans les glandes endocrines individualisées (formant des organes) : hypophyse, thyroïde, parathyroïdes, surrénales, etc. Les tumeurs du système endocrinien diffus, qui sont de nature neuroendocrine, sont traitées plus loin.
Comme dans les autres parenchymes glandulaires, on identifie dans les glandes endocrines des tumeurs bénignes (adénomes) et des tumeurs malignes (adénocarcinomes). Les caractéristiques macroscopiques et microscopiques générales exposées ci-dessus à propos des tumeurs des glandes exocrines restent valables.
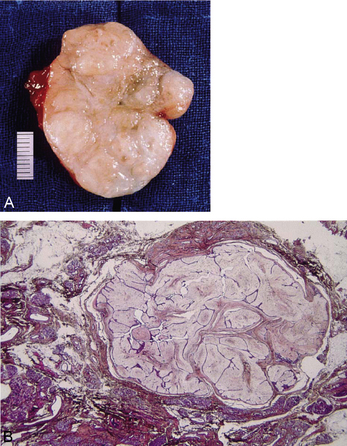
Les tumeurs bénignes sont de loin les plus fréquentes. Dans la thyroïde, qui est la glande endocrine le plus souvent atteinte, l’adénome se présente comme un nodule plein (ou parfois kystique), bien délimité et encapsulé, refoulant le tissu thyroïdien normal en périphérie. Microscopiquement, la tumeur est très bien différenciée, reproduisant un tissu morphologiquement très proche du tissu thyroïdien normal : l’adénome est formé par des vésicules contenant de la colloïde et bordées par des cellules cubiques ressemblant à des thyréocytes (figure 10.24).
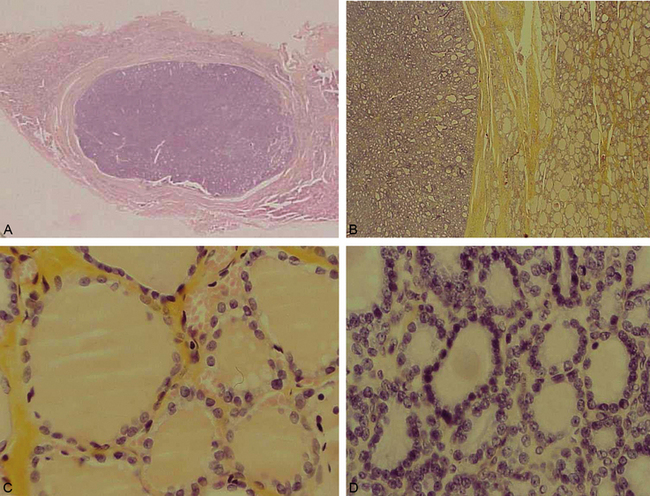
Figure 10.24 Adénome thyroïdien. A. Coupe montée : la tumeur est très bien délimitée par rapport au tissu thyroïdien adjacent. B. Faible grandissement, montrant la bonne délimitation de la tumeur, entourée par une capsule fibreuse. Forts grandissements montrant le tissu thyroïdien sain (C) et la tumeur (D) : cette dernière est bien différenciée et conserve une architecture vésiculaire évidente, très proche de celle du tissu normal.
Concernant les adénocarcinomes des glandes endocrines, la glande le plus souvent atteinte est la thyroïde (adénocarcinome papillaire), tandis que les tumeurs malignes de la corticosurrénale (corticosurrénalome malin), de la parathyroïde ou de l’hypophyse restent exceptionnelles.
Une particularité des tumeurs des glandes endocrines est leur capacité à produire des hormones. Ainsi, certains adénomes, dits hyperfonctionnels, peuvent être révélés par des troubles endocriniens : hypercalcémie par hypersécrétion de parathormone dans un adénome parathyroïdien, hyperthyroïdie due à un adénome thyroïdien hyperfonctionnel (nodule « chaud » à la scintigraphie). Ceci n’est pas constant et d’autres adénomes sont non fonctionnels : c’est d’ailleurs le cas le plus fréquent pour les adénomes thyroïdiens, qui ne secrètent pas (ou peu) d’hormones thyroïdiennes, ne captant pas l’iode (nodule « froid » à la scintigraphie).
Tumeurs urothéliales
Ce sont les tumeurs qui se développent à partir de l’épithélium transitionnel (ou urothélium) revêtant les voies excréto-urinaires : bassinet, uretères et surtout vessie.
• Fréquence : six nouveaux cas par an de tumeurs urothéliales de vessie en France pour 100 000 habitants, survenant de préférence chez l’homme après 40 ans.
• Facteurs de risque : le tabac, l’exposition professionnelle à certains colorants (aniline).
• Présentation clinique : l’hématurie et les troubles mictionnels sont les signes révélateurs les plus fréquents.
Les tumeurs urothéliales ont la particularité de former macroscopiquement dans 75 % des cas des tumeurs en saillie sur la muqueuse, avec un aspect papillaire.
Les tumeurs urothéliales papillaires constituent un groupe de tumeurs très particulier car elles forment une véritable maladie de l’urothélium, souvent multicentrique (papillomatose) avec la capacité de récidiver au même endroit ou ailleurs dans la vessie ou dans la voie excrétrice haute. Le potentiel d’agressivité de ces tumeurs est déterminé par leur grade cytologique (ou degré de différenciation) et leur niveau d’infiltration dans la paroi (stade). Ceci permet de classer ces tumeurs papillaires en : tumeur papillaire de faible potentiel de malignité, carcinome de bas grade et carcinome de haut grade.
Au cours des récidives les tumeurs papillaires peuvent s’aggraver et devenir infiltrantes dans la paroi. Tant qu’une tumeur n’infiltre pas le muscle vésical on se contente de la réséquer par voie endoscopique. Lorsqu’elle infiltre le muscle il faut enlever la vessie (cystectomie).
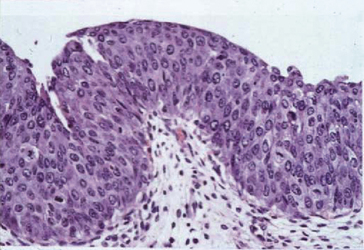
Chez 15 % des patients la tumeur est infiltrante d’emblée (carcinome infiltrant), pouvant donner des métastases. Ces carcinomes infiltrants d’emblée proviennent de lésions planes de carcinome in situ (CIS) (figure 10.25).
C’est dire l’importance d’exercer une surveillance chez les patients ayant une tumeur de vessie : surveillance radiologique échographique, cytologique. Il faut insister sur la valeur de la cytologie urinaire pour dépister le CIS.
Tumeurs neuroendocrines
Elles sont développées à partir des cellules neuroendocrines (système endocrinien diffus). On les observe essentiellement dans le tube digestif et les bronches, dans le pancréas et beaucoup plus rarement dans d’autres localisations (thymus, thyroïde [à partir des cellules à calcitonine], peau…).
Les cellules appartenant au système endocrinien diffus partagent, outre leur disposition particulière dans les organes (cellules isolées ou en petits nids) des caractéris tiques fonctionnelles communes telles que la sécrétion d’hormones peptidiques par l’intermédiaire de grains sécrétoires cytoplasmiques et l’expression de protéines communes avec le système nerveux (synaptophysine, N-CAM [Neural-cell adhesion molecule]). Pour cette raison, elles sont désignées sous le terme de cellules neuroendocrines, et les tumeurs sont appelées tumeurs neuroendocrines.
Ces caractéristiques fonctionnelles communes sont largement utilisées pour le diagnostic anatomopathologique des tumeurs neuroendocrines, dont elles constituent des marqueurs de différenciation : en immunohistochimie, les grains neurosécrétoires peuvent être mis en évidence par des anticorps anti-chromogranine (figure 10.26) ; des anticorps dirigés contre la synaptophysine ou contre N-CAM sont également utilisés, de même que la recherche de produits de sécrétions spécifiques : gastrine, insuline…
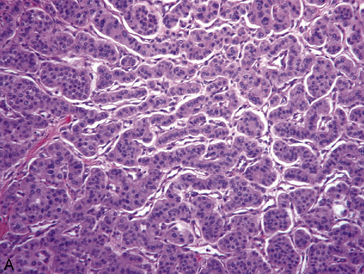
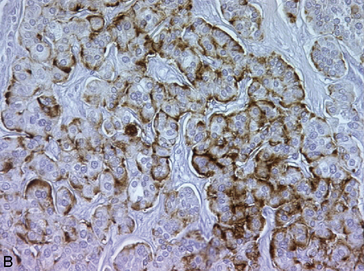
Figure 10.26 Tumeur neuroendocrine bien différenciée. A. HES : tumeur faite de cellules régulières agencées en cordons séparés par des capillaires sanguins. B. Immunohistochimie avec un anticorps anti-chromogranine : marquage des cellules tumorales.
Actuellement, on considère qu’il n’existe pas de tumeurs neuroendocrines véritablement bénignes. Toutes les tumeurs neuroendocrines ont un certain potentiel de malignité, mais celui-ci varie de façon très importante selon le degré de différenciation de la tumeur. La distinction entre les tumeurs neuroendocrines bien différenciées et peu différenciées revêt donc une grande importance pour l’évaluation du pronostic.
Tumeurs neuroendocrines bien différenciées
Ce sont les plus fréquentes, notamment dans le tube digestif et le pancréas. Elles sont parfois appelées « tumeurs carcinoïdes», mais cette appellation n’est pas admise dans tous les organes, et n’est actuellement utilisée que dans l’appareil broncho-pulmonaire et éventuellement pour l’appendice (pour plus d’informations, voir le complément en ligne En savoir plus 10.2 ![]() : « Carcinoïdes »).
: « Carcinoïdes »).
En savoir plus 10.2
Carcinoïdes
Le terme « carcinoïde » désigne l’architecture qu’adopte la prolifération tumorale dans de nombreuses tumeurs endocrines et neuroendocrines bien différenciées : les cellules se disposent en îlots, en nids ou en travées séparés par un abondant réseau capillaire sanguin.
Ce terme a été largement utilisé par le passé comme synonyme de tumeur neuroendocrine bien différenciée, mais est maintenant progressivement abandonné au profit de cette dernière appellation, sauf dans deux organes :
• le poumon et les bronches, où il désigne une tumeur neuroendocrine très bien différenciée (carcinoïde typique) ou un peu moins bien différenciée (carcinoïde atypique, tumeur qui ressemble au carcinoïde typique mais possède plus de mitoses, des phénomènes de nécrose et pour laquelle les métastases sont plus fréquentes et le pronostic plus réservé) ;
• l’appendice, où le carcinoïde est relativement fréquent, secrétant en règle générale de la sérotonine ; la tumeur est souvent découverte fortuitement à l’occasion de l’examen anatomopathologique d’une pièce d’appendicectomie (à l’occasion d’une appendicite).
Il s’agit de tumeurs assez bien circonscrites (masse arrondie saillant sous la muqueuse bronchique ou dans la muqueuse du tube digestif), de croissance lente et longtemps locale.
Aspect macroscopique : masse arrondie, bien limitée, de coloration souvent jaune ou beige, pouvant former un polype plus ou moins enchâssé dans la paroi lorsque la tumeur touche un organe creux.
Aspect microscopique : la tumeur est constituée d’îlots ou de travées cellulaires séparés les uns des autres par un riche réseau capillaire (architecture endocrinoïde –figure 10.26). Les cellules sont régulières et l’activité mitotique souvent très faible. Il existe parfois une sécrétion hormonale (insuline, gastrine…), responsable d’un syndrome endocrinien clinique caractéristique.
Pronostic : les tumeurs neuroendocrines bien différenciées ont une évolution lente, longtemps locale. Le risque d’extension ganglionnaire lymphatique et de métastase viscérale est plus important lorsque la tumeur est volumineuse (ou envahit profondément la paroi du viscère [tube digestif]) et lorsque l’activité mitotique est plus importante. Même lorsqu’il existe des métastases viscérales (habituellement hépatiques), une survie prolongée est souvent observée.
Tumeurs neuroendocrines peu différenciées
Leur agressivité est beaucoup plus importante que celle des tumeurs neuroendocrines bien différenciées, et ces tumeurs manifestement malignes sont souvent appelées « carcinomes neuroendocrines (peu différenciés)». Il s’agit principalement du carcinome à petites cellules. Les autres variétés, plus rares, ne sont pas décrites ici.
Bien que son nom ne l’indique pas explicitement, le carcinome à petites cellules est une tumeur neuroendocrine de haut degré de malignité dont la localisation la plus fréquente est broncho-pulmonaire, beaucoup plus rare dans les autres organes (ovaire, col utérin, larynx, tube digestif, vessie…). Dans le poumon, où elle représente environ 20 % des cancers, cette tumeur survient presque exclusivement chez le fumeur. Histologiquement, la tumeur est faite de nappes de petites cellules (au noyau parfois décrit « en grain d’avoine »), comportant une très forte activité mitotique, sans signe de différenciation (figure 10.27). C’est seulement l’immunohistochimie qui permet d’identifier une différenciation neuroendocrine (expression de chromogranine, synaptophysine et/ou N-CAM). Ce carcinome est d’évolution très rapide et s’accompagne précocement de métastases (ganglions médiastinaux, foie, cerveau, moelle osseuse), rendant la chirurgie inutile. Il est initialement chimiosensible, mais le pronostic à moyen terme est très sombre.
Carcinomes indifférenciés
Au terme de l’examen histopathologique conventionnel, complété par l’utilisation de techniques complémentaires (colorations spéciales à la recherche de mucus, immunohistochimie, etc.), certains carcinomes ne présentent aucun signe morphologique ou fonctionnel permettant de reconnaître une différenciation particulière. Ils sont dénommés carcinomes indifférenciés.
Le problème est parfois même de déterminer que le cancer est bien d’origine épithéliale, et ainsi d’éliminer un autre type de cancer, qui pourrait bénéficier d’un traitement spécifique : lymphome, tumeur germinale, ou autre type de cancer. Ce diagnostic repose le plus souvent sur une technique immunohistochimique détectant des antigènes exprimés par des cellules épithéliales (cytokératines, par exemple) et non des antigènes exprimés par les autres lignées.
Tumeurs malpighiennes
Les tumeurs malpighiennes bénignes (papillome, condylome) et malignes se développent le plus souvent aux dépens des épithéliums malpighiens (épiderme et muqueuses malpighiennes). Il faut toutefois connaître la possibilité de carcinomes épidermoïdes métaplasiques, développés au niveau d’une muqueuse glandulaire (cas des carcinomes épidermoïdes bronchiques). Les tumeurs malignes malpighiennes sont dénommées carcinomes épidermoïdes et doivent être classées en fonction de leur degré de différenciation.
Au niveau cutané, les carcinomes épidermoïdes sont en règle générale diagnostiqués assez précocement : ils peuvent toutefois donner des métastases ganglionnaires et très rarement des métastases viscérales. Le carcinome basocellulaire est une variété particulière de carcinome qui n’existe qu’au niveau de la peau. Il s’agit d’une tumeur dont l’agressivité est uniquement locale et qui ne donne pas de métastase.
Dans les localisations extra-cutanées, l’évolution loco-régionale des carcinomes épidermoïdes est souvent plus importante au moment du diagnostic, avec un risque nettement plus élevé d’atteinte ganglionnaire et de métastases viscérales. Certains facteurs de risque sont particulièrement importants dans certaines localisations : infection à papillomavirus pour le col utérin, tabagisme (voies aéro-digestives supérieures, bronches), exposition solaire (peau).
Tumeurs glandulaires
Les tumeurs épithéliales à différenciation glandulaire peuvent être bénignes (adénomes) ou malignes (adénocarcinomes) et se développent essentiellement au niveau des muqueuses glandulaires (côlon, endomètre) et des parenchymes glandulaires ou assimilés (sein, pancréas, poumon…), en dehors du cas de certains adénocarcinomes métaplasiques, développés au niveau d’une muqueuse malpighiennes (adénocarcinome du bas œsophage).
Dans les organes creux, les adénocarcinomes se présentent sous une forme ulcérée, bourgeonnante ou infiltrante (formes souvent associées). Ils infiltrent plus ou moins profondément la paroi du viscère. Dans les organes pleins, ils forment des masses tumorales nodulaires à contour souvent irrégulier et d’aspect hétérogène (nécrose, hémorragie…).
Les adénocarcinomes sont classés en fonction de leur degré de différenciation, qui se manifeste notamment par une organisation glandulaire ou la sécrétion de mucus (ou autre produit de sécrétion). Dans le côlon, les tumeurs bénignes (adénomes) sont des lésions précancéreuses.
Tumeurs urothéliales
Les tumeurs urothéliales sont surtout développées dans la vessie. Elles sont souvent papillaires et à développement longtemps superficiel, autorisant un traitement local par résection, mais comportent un risque important de récidive (localement ou ailleurs dans la vessie et l’arbre urinaire). Lorsqu’elles sont plus agressives (tumeurs de haut grade, infiltrant le détrusor), elles doivent alors faire l’objet d’un traitement chirurgical plus radical.
Tumeurs neuroendocrines
Les tumeurs neuroendocrines représentent principalement les tumeurs des cellules du système endocrinien diffus (muqueuses digestives et respiratoires, notamment).
Elles siègent surtout dans le tube digestif et le pancréas, où les tumeurs sont souvent bien différenciées (parfois appelées tumeurs carcinoïdes), avec une croissance lente, une évolution surtout loco-régionale et un risque métastatique faible ou modéré.
La situation est inverse dans le tractus broncho-pulmonaire où la tumeur neuroendocrine la plus fréquente est le carcinome à petites cellules (20 % environ des cancers broncho-pulmonaires). Cette tumeur est fortement associée au tabagisme, très agressive et de pronostic sombre, avec des métastases viscérales précoces.
Carcinomes indifférenciés
Après examen morphologique minutieux et utilisation de différentes techniques complémentaires (notamment immunohistochimique), un carcinome peut ne montrer aucun signe de différenciation (épidermoïde, glandulaire…) : il s’agit alors d’un carcinome indifférencié. Il est important de pouvoir au moins affirmer la nature carcinomateuse de la tumeur, de façon à exclure une tumeur maligne non carcinomateuse pouvant éventuellement bénéficier d’un traitement particulier (lymphome, mélanome, tumeur germinale, sarcome…).
QCM 4
Parmi les propositions suivantes concernant un carcinome épidermoïde différencié, laquelle (lesquelles) est (sont) exacte(s) ?
QCM 5
Parmi les organes suivants, pour lequel (lesquels) les carcinomes épidermoïdes sont-ils les tumeurs malignes primitives les plus fréquentes ?
QCM 8
Les néoplasies malignes du sein :
A. Sont aussi fréquentes que celles de l’ovaire
B. Sont le plus souvent des carcinomes épidermoïdes
C. Sont le plus souvent des sarcomes
D. Sont formellement diagnostiquées à la mammographie lorsqu’existent des microcalcifications
E. Se présentent souvent macroscopiquement sous la forme d’un nodule à contour irrégulier