3 Les mécanismes physiopathologiques
COMPRENDRE
INTRODUCTION
Le processus dégénératif est déclenché par l’exposition à des facteurs prédisposants et/ou précipitants. Il est à l’origine de nombreuses maladies affectant les grandes fonctions de l’organisme. Les fonctions altérées sont qualifiées d’insuffisantes, et l’évolution est le plus souvent défavorable et inexorable. Le stade ultime de l’insuffisance est la défaillance organique qui entraîne, lorsqu’il n’existe pas de stabilisation, une multidéfaillance.
La dégénérescence s’applique à toute modification cellulaire vers le stade morbide impliquant la disparition progressive des structures normales des cellules, du tissu ou de l’organe concerné sans processus inflammatoire et/ou tumoral. Sur le plan cellulaire, la dégénérescence représente le stade ultime de la diminution des métabolismes cellulaires avec disparition de certains d’entre eux ; elle peut aboutir à la nécrose cellulaire.
RAPPEL ANATOMOPHYSIOLOGIQUE DE LA CELLULE31
La cellule est la plus petite unité structurale et fonctionnelle des êtres vivants. Elle synthétise l’ensemble de ses constituants en utilisant les éléments du milieu extracellulaire. Comme tous les êtres vivants, elle est douée de capacités de croissance, de multiplication et de mort.
Elle assure sa propre homéostasie (biochimie). Cependant, dans le même temps, elle doit répondre aux besoins de l’organisme. Pour cela, elle doit être réceptive aux différents messages qui lui sont adressés par ce dernier.
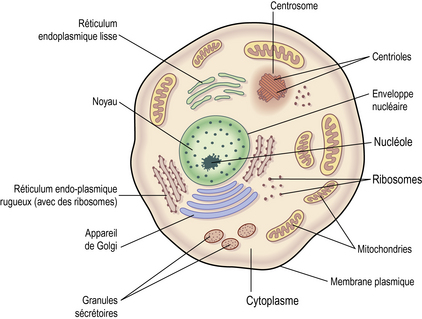
Toute cellule est caractérisée par une membrane, un noyau (hormis les hématies qui sont dépourvues de noyau) et un cytoplasme. On note la présence de nombreuses protéines à l’intérieur des cellules. Les processus biochimiques sont réalisés dans les différents organites cellulaires (ou organelles), tels : les mitochondries, les ribosomes, l’appareil de Golgi, les endosomes, les lysosomes, les peroxysomes et le cytosquelette situés dans le cytoplasme. Ils interviennent dans les processus de synthèse ou de dégradation métaboliques qui constituent le métabolisme cellulaire.
 Structure et fonction
Structure et fonction
Chaque cellule présente, entre autres, une forme et une rigidité (ou une souplesse) variables du fait de sa différenciation, de sa localisation et de sa fonction. Elle contient plus ou moins de cytosquelette, élément qui lui donne sa rigidité. Plus sa quantité est importante, plus la cellule est rigide. Le cytosquelette intervient aussi dans la contraction, le mouvement et la division cellulaire. Il est composé de plusieurs types de filaments, des filaments souples d’actine polymérisée, des petits filaments dits intermédiaires (au rôle mal connu) et des microtubules32 rigides.
– Les cellules se différencient33 et se spécialisent. Leur spécialisation est liée à des caractéristiques propres.
– Les cellules nerveuses présentent un abondant cytosquelette destiné au transport des neurotransmetteurs.
– Les cellules musculaires présentent un abondant cytosquelette destiné à assurer la contraction.
– Les cellules leucocytaires présentent de nombreux lysosomes pour éliminer les micro-organismes.
– Les cellules hépatiques contiennent de nombreux peroxysomes qui assurent la détoxication du sang.
– Les cellules pancréatiques contiennent beaucoup d’appareils de Golgi en rapport avec la production de suc pancréatique.
La régénération cellulaire est variable selon les cellules, ce phénomène constitue une autre caractéristique des cellules. On distingue trois catégories.
– Les cellules labiles dont la réplication cellulaire constitue un processus continu : les cellules se régénèrent très vite. Sont concernées les cellules épithéliales, les muqueuses…
– Les cellules stables pour lesquelles la réplication existe mais est moins fréquente. Sont concernés les cellules du foie, des reins, du pancréas et les fibroblastes ;
– Les cellules permanentes pour lesquelles la réplication est inexistante après la fin de leur croissance. Sont concernés : les neurones, les cellules des muscles squelettiques, les cellules cardiaques. Dans ce dernier cas, en présence de lésions majeures, les tissus sont remplacés par un tissu fibreux qui n’est pas en mesure d’assurer les fonctions antérieures du tissu originel.
Ces cellules (musculaires, cardiaques ou nerveuses) qui ont un taux de renouvellement très faible ont « l’âge » de l’organe auquel elles appartiennent, et leur vieillissement se caractérise par l’accumulation de lipofuscine. La lipofuscine est un pigment qui résulte de la dégradation des organites cellulaires et qui entrave le bon fonctionnement cellulaire.
![]() Par exemple, des cellules spécialisées (comme les cellules du foie) perdent une partie de leur capacité de détoxication, elles accumulent alors des déchets métaboliques.
Par exemple, des cellules spécialisées (comme les cellules du foie) perdent une partie de leur capacité de détoxication, elles accumulent alors des déchets métaboliques.
Le processus dégénératif peut prendre des formes diverses selon le type de cellule.
 Fonction de synthèse
Fonction de synthèse
Chaque type de cellule a une fonction de synthèse spécifique, une synthèse chimique étant un enchaînement de réactions chimiques mis en œuvre pour l’obtention d’un ou de plusieurs produits finaux. Toute altération cellulaire aura nécessairement un impact sur sa capacité de synthèse.
Le noyau est le lieu de localisation de l’acide désoxyribonucléique ou ADN et de la réplication de l’information qu’il contient. C’est aussi le lieu de synthèse des acides ribonucléiques ou ARN, messagers, de transfert et ribosomaux.
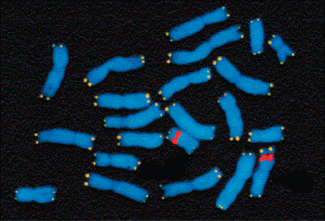
À l’intérieur du noyau se trouvent les chromosomes, supports de l’information génétique. Ils sont constitués de télomères – un télomère étant la région située à l’extrémité d’un chromosome linéaire. Chez les êtres humains, les télomères rétrécissent à chaque fois qu’une cellule se divise (à l’exception des cellules germinales qui possèdent une télomérase très active, en raison de l’incapacité de la machinerie cellulaire à « dupliquer » les derniers éléments de cette structure d’ADN). Cette perte d’information génétique serait responsable de plusieurs types de maladies et du vieillissement (cf. facteurs favorisants) (figure 3.1).
La mitochondrie est l’organite assurant les processus énergétiques cellulaires. En effet, elle est le siège du métabolisme de l’oxygène et de la synthèse de l’adénosine triphosphate ou ATP, molécule qui fournit par hydrolyse l’énergie nécessaire aux réactions chimiques du métabolisme. Elle produit l’énergie grâce à l’oxygène inspiré. Ce processus est rendu possible par la chaîne de transport des électrons (regroupements de plusieurs protéines) qui est située dans la membrane mitochondriale. Du fait de ces nombreuses activités de synthèse, cette structure est la principale source de production cellulaire de radicaux libres (figure 3.2).
Le réticulum endoplasmique (RE) est un organite uniquement présent dans les cellules eucaryotes. Le réticulum endoplasmique rugueux intervient dans la synthèse des glycoprotéines, le RE lisse intervient quant à lui dans la synthèse des lipides.
L’appareil de Golgi est un organite des cellules biologiques qui joue un rôle majeur dans le processus d’exocytose. Il permet de faire le lien entre le réticulum endoplasmique et la membrane plasmique. Il régule le transport vésiculaire et se charge de modifier les protéines par réaction de glycosylation, de sulfatation, etc. Il est composé de deux faces : le site cis, face d’entrée des protéines sécrétées par le réticulum et le site trans, face de sortie des vésicules.
MÉCANISMES DÉGÉNÉRATIFS
 Généralités
Généralités
Selon l’agent causal, le mécanisme déclenché varie. Toutefois, il aboutit toujours à une dégénérescence. Plusieurs types de modifications sont identifiés, certaines d’entre elles sont réversibles comme l’hyperplasie, d’autres sont définitives telles la nécrose ou l’apoptose.
Le processus dégénératif est un phénomène progressif qui entraîne une dégénérescence des organes.
La dégénérescence résulte d’un processus de dégradation totale ou partielle d’une cellule, d’un tissu, d’un ou plusieurs organes. Les cellules se modifient, perdent leurs caractéristiques spécifiques et leur fonctionnalité pour se transformer en une entité « inerte ». Ces transformations altèrent progressivement le fonctionnement de la cellule, du tissu ou de l’organe jusqu’à aboutir à sa défaillance. Il existe une dégénérescence physiologique dans le cas du vieillissement normal. Celle-ci peut concerner une fonction particulière, comme par exemple la fonction de reproduction qui s’arrête à un moment donné de la vie de l’individu.
• La ménopause chez la femme est caractérisée biologiquement par une hypotrophie des ovaires entraînant une diminution, voire un arrêt de la production d’hormones.
• Le vieillissement cardio-vasculaire se traduit par une diminution du nombre des myocytes et leur hypertrophie. La force de contraction des fibres est identique mais les durées de contraction et de relaxation sont augmentées.
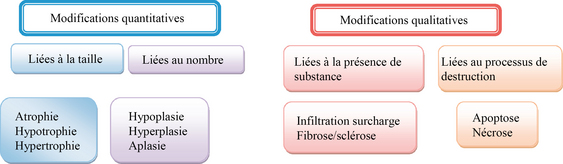
Les modifications cellulaires sont deux types, quantitatifs et qualitatifs, les premiers pouvant être la conséquence des seconds.
 Modifications quantitatives
Modifications quantitatives
Les modifications quantitatives sont liées à la taille ou au nombre de cellules. Pour les différencier on utilise des préfixes accolés aux termes « trophie » qui signifie la nourriture, le développement, et « plasie » qui signifie la formation.
 Modifications liées à la taille des cellules
Modifications liées à la taille des cellules
Les facteurs prédisposants et/ou précipitants vus au chapitre précédent ont un impact sur la cellule qui se modifie en augmentant ou en diminuant son volume. Les cellules nécessitent des stimuli pour se multiplier et croître, et ainsi effectuer leurs missions. Pour y parvenir, il est indispensable qu’elles reçoivent les substances nécessaires à leur vie et à leur développement. Ainsi, les apports nutritionnels et respiratoires sont-ils déterminants, tout comme les stimuli nerveux et hormonaux. Ils ont un impact sur la taille de la cellule qui peut être augmentée, on parle dans ce cas d’hypertrophie, ou diminuée, on parle alors d’hypotrophie et d’atrophie.
 Atrophie/hypotrophie
Atrophie/hypotrophie
C’est la diminution normalement réversible de la masse d’une cellule (après avoir atteint une maturité normale) en rapport avec une diminution de son activité. Elle se traduit par une réduction de sa taille et éventuellement la disparition de certains de ses constituants. Elle peut concerner les tissus et les organes et correspond alors à un défaut de nutrition des organes et des tissus, caractérisé par une diminution notable de leur volume et de leur poids. Elle est la conséquence d’une diminution du métabolisme cellulaire.
L’atrophie musculaire
Le défaut de nutrition peut être dû au vieillissement et/ou à des troubles trophiques. En effet, une diminution de l’innervation ou du stimulus hormonal et/ou de la vascularisation peut conduire à une baisse de volume musculaire. Cette baisse peut être due soit à une insuffisance d’information par voie nerveuse ou hormonale, soit à une insuffisance d’apport en nutriments ou en oxygène, éléments indispensables pour entretenir les cellules. Il en résulte une hypotrophie puis une atrophie musculaire, et ainsi une diminution de la fonction locomotrice qui permet la mobilisation, le déplacement, la préhension (cf. fonction locomotrice).
La masse musculaire est différente selon le genre, puisqu’elle est sous dépendance hormonale, notamment la testostérone. Ce qui explique la fonte musculaire des personnes âgées.
La sarcopénie : la masse musculaire est maximale vers 35 ans puis diminue progressivement. La force baisse de 25 à 35 % chez l’homme entre 50 et 70 ans, en raison de l’atrophie de certaines fibres. Ces transformations ont pour conséquence une diminution de l’aptitude à réaliser une activité physique d’endurance et de force, et favorisent la survenue d’une fatigue et d’une incapacité à réaliser des activités courantes.
![]() L’activité musculaire dépend de la capacité de contraction des muscles. Lorsque celle-ci devient impossible, quelle qu’en soit la raison (immobilisation d’un membre par une contention plâtrée, commande nerveuse inexistante), la diminution du métabolisme cellulaire aboutit à une atrophie musculaire. En cas d’étiologie réversible (contention plâtrée), la reprise de l’activité musculaire entraînera la relance de l’activité cellulaire et un retour à l’état antérieur.
L’activité musculaire dépend de la capacité de contraction des muscles. Lorsque celle-ci devient impossible, quelle qu’en soit la raison (immobilisation d’un membre par une contention plâtrée, commande nerveuse inexistante), la diminution du métabolisme cellulaire aboutit à une atrophie musculaire. En cas d’étiologie réversible (contention plâtrée), la reprise de l’activité musculaire entraînera la relance de l’activité cellulaire et un retour à l’état antérieur.
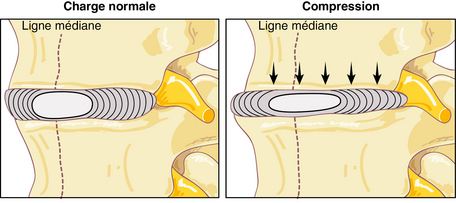
Alors que les disques intervertébraux contiennent 90 % d’eau à la naissance, ce taux passe à 70 % à 60 ans. On constate alors une diminution de la taille du disque avec un état de déshydratation (figure 3.3). Avec le vieillissement, ils perdent de leur élasticité. Les sportifs qui pratiquent une activité entraînant une pression sur la colonne vertébrale sont aussi des sujets à risque. Les facteurs qui peuvent accélérer le phénomène sont les traumatismes fréquents, la nutrition déficiente et le manque d’exercice.
L’atrophie gliale
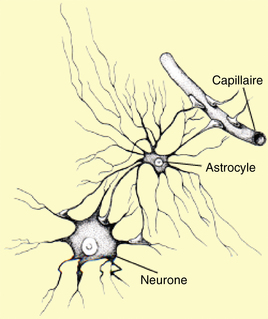
Les astrocytes, également appelés macroglies, sont les cellules gliales les plus nombreuses. Elles isolent les neurones les uns des autres en comblant l’espace situé entre eux. Même si leur rôle reste en grande partie aujourd’hui inconnu, on sait toutefois qu’elles interviennent dans les échanges avec le milieu extracellulaire et jouent un rôle dans la nutrition de la cellule. Elles présentent des prolongements cytoplasmiques fibreux qui leur donnent l’apparence d’une étoile. Lorsqu’ils sont endommagés, il se produit une prolifération de leur prolongement qui forme ainsi une gliose suivie de l’apparition d’une atrophie cellulaire. Lorsqu’ils sont sévèrement endommagés, ils se nécrosent et se désintègrent (figure 3.4).
 Hypertrophie
Hypertrophie
Elle correspond à l’augmentation exagérée du volume des cellules, et donc par voie de conséquence des tissus et des organes. L’hypertrophie peut être liée soit à l’augmentation de l’activité de la cellule ou du tissu concerné (activité mécanique ou métabolique) soit être la conséquence d’une accumulation de substances anormales dans le cytoplasme de la cellule.
• La pratique intensive d’un sport entraîne l’hypertrophie des muscles locomoteurs sollicités par l’athlète. L’arrêt de la pratique sportive entraînera un retour à l’état antérieur.
• L’hypertrophie peut être physiologique ou pathologique. Citons l’hypertrophie du myomètre lors de la grossesse et l’hypertrophie du muscle cardiaque conséquence d’une éjection ventriculaire insuffisante.
 Modifications liées au nombre de cellules
Modifications liées au nombre de cellules
Le nombre de cellules d’un tissu peut être augmenté (il s’agit alors d’une hyperplasie) ou diminué (il s’agit alors d’une hypoplasie). En l’absence de renouvellement, on parle d’aplasie.
 Hyperplasie
Hyperplasie
L’hyperplasie correspond à la formation d’un tissu pathologique aux dépens d’un tissu sain, alors que les éléments néoformés ne diffèrent en rien, ni dans leur forme, ni dans leurs fonctions. C’est donc une hypertrophie organique par multiplication des cellules qui le constitue. L’hyperplasie signe une hyperactivité cellulaire. Néanmoins, la multiplication cellulaire n’est pas anarchique comme c’est le cas dans un processus tumoral. Elle reste sous le contrôle des mécanismes de régulation de la prolifération cellulaire.
Les causes sont multiples. Localement, on retrouve l’inflammation chronique et les agents infectieux. Au plan général, la principale cause est une perturbation hormonale, qui se traduit par un défaut de transmission des messages intercellulaires qui aboutissent à un dysfonctionnement.
 Hypoplasie
Hypoplasie
L’hypoplasie correspond à une diminution de l’activité formatrice des tissus, d’un développement insuffisant d’un organe ou d’un tissu. Elle traduit un ralentissement de la multiplication des cellules, ralentissement qui peut être dû soit à une diminution de la trophicité cellulaire, soit à une multiplication anormalement faible du fait d’un agent causal. Elle aboutit à un développement insuffisant de tout ou partie d’un viscère qui donne in fine un organe trop petit mais généralement fonctionnel. L’hypoplasie est présente lors du vieillissement physiologique, elle aboutit à une altération de la fonction avec diminution des capacités.
 Aplasie
Aplasie
L’aplasie correspond à l’arrêt du développement d’un tissu ou d’un organe survenant avant ou après la naissance. L’aplasie est liée au vieillissement physiologique ou à l’action d’agents causaux. Ainsi, les radiations lors d’une radiothérapie intensive impactent toutes les cellules à reproduction rapide comme les cellules sanguines.
 Modifications qualitatives
Modifications qualitatives
Dans les modifications qualitatives, on identifie : l’infiltration, la surcharge, la fibrose (ou la sclérose), l’apoptose et la nécrose.
 Modifications qualitatives liées à la présence de substances
Modifications qualitatives liées à la présence de substances
 Infiltration
Infiltration
L’infiltration correspond à un engorgement formé par la présence d’une substance anormale dans la cellule ou dans le tissu. Elle peut être d’origine liquidienne, graisseuse ou minérale. Elle peut être endogène ou exogène. L’infiltration est endogène lorsqu’elle se situe dans le cytoplasme cellulaire, elle est exogène lorsqu’elle se situe entre les éléments anatomiques d’un tissu.
L’infiltration, qu’elle soit endogène ou exogène, entraîne toujours une diminution de la fonctionnalité. Ainsi, l’infiltration des tissus a pour conséquence un abaissement du métabolisme cellulaire.
L’infiltration graisseuse
L’infiltration graisseuse (tissu adipeux) au niveau musculaire engendre l’insulino-résistance qui précède un diabète de type 2.
Une infiltration particulière : la substance amyloïde
La substance amyloïde qui est une substance protéique ressemblant à des grains d’amidon peut infiltrer différents tissus et/ou organes sous l’influence de mécanismes immunitaires dont certains seraient héréditaires. Exemples : amyloïdose cutanée, maladie amyloïde… (figure 3.5)
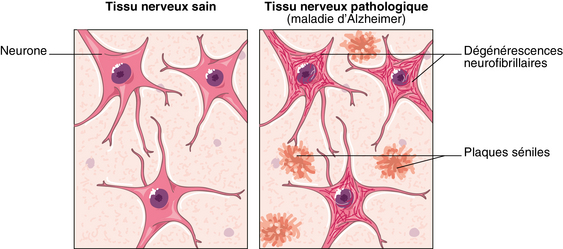
L’amylose34 est une maladie rare caractérisée par le dépôt d’une substance amyloïde dans un ou plusieurs organes. Cette substance s’accumule dans tous les tissus concernés impactant rapidement leur fonctionnalité. Il existe des amyloses primitives – pathologies rares –, et des amyloses secondaires, ce qui est le cas de la maladie d’Alzheimer (MA). Dans ce dernier cas, l’examen neuropathologique permet de démontrer la présence de deux types de lésions cérébrales, les plaques amyloïdes extracellulaires et l’accumulation intraneuronale de fibrilles (formées de filaments caractéristiques) en abondance dans la substance grise du néocortex. On distingue donc deux processus dégénératifs distincts à l’origine de ces lésions : l’amyloïdogenèse (infiltration exogène) et la dégénérescence neurofibrillaire (DNF), surcharge en protéine Tau (cf. infra).
La protéine mise en jeu est la protéine amyloïde. C’est une protéine membranaire qui se détache de la membrane et entre dans le milieu extracellulaire. Elle est ensuite récupérée puis dégradée. Dans la maladie d’Alzheimer, cette dégradation est incomplète et un fragment appelé β-amyloïde, qui ne peut être dégradé, demeure dans le milieu extracellulaire. Ce sont ces fragments qui vont s’agréger et former les plaques amyloïdes. En s’accumulant dans le milieu extracellulaire, ces plaques finissent par comprimer les neurones. Cette compression est responsable de dysfonctionnement cellulaire et de la mort neuronale de nombreuses cellules.
 Surcharge
Surcharge
La surcharge correspond à l’accumulation pathologique d’une substance normalement présente en quantité inférieure dans une cellule ou un tissu.
La dégénérescence neurofibrillaire identifiée dans la maladie d’Alzheimer (MA) correspond à l’accumulation intraneuronale des protéines Tau sous forme de filaments pathologiques.
• La stéatose est l’accumulation de triglycérides dans le cytoplasme de cellules qui normalement n’en contiennent que des traces non observables en microscopie optique. Elle correspond donc à une surcharge. La stéatose hépatique est la plus commune.
• La quantité du collagène du tissu extracellulaire myocardique augmente au cours de vieillissement, ce qui le rend plus rigide par une glycation non enzymatique.
L’extension corticale de ce processus d’agrégation de Tau constitue la tauopathie, qui apparaît systématiquement au cours du vieillissement cérébral dans la région entorhinale puis hippocampique. Cependant, au cours de la MA, la pathologie Tau progresse en remontant les connexions nerveuses selon un chemin bien précis : cortex temporal (antérieur, puis inférieur, médian et enfin supérieur). À ce stade, le patient présente des troubles légers mais il n’est pas dément.
Puis, le processus dégénératif progresse et altère au fur et à mesure les réseaux neuronaux impliqués dans la mémoire récente (hippocampe) puis la mémoire sémantique (lobe temporal), le langage (lobe frontal), les praxies et les gnosies (pariétal). L’évolution est fatale puisque les microfibrilles accumulées vont provoquer la dégénérescence puis la mort des neurones qui seront digérés par les cellules gliales (figure 3.6).
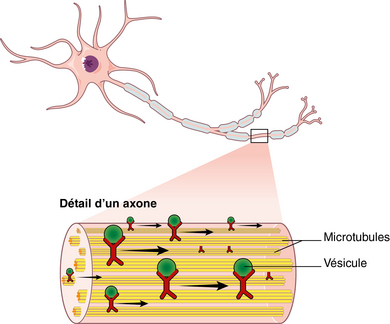
Les protéines Tau, présentes dans les microtubules, sont perpendiculaires à l’axone. Elles assurent la rigidité des microtubules et un bon transport axonal. Normalement, des protéines Tau se détachent périodiquement des microtubules, elles sont remplacées et rapidement dégradées chez le sujet sain. Dans la maladie d’Alzheimer, les protéines Tau se détachent des microtubules et tombent dans le milieu intracellulaire. En l’absence de dégradation, elles s’agrègent et forment les neurofibrilles. Leur présence en grand nombre bloque le fonctionnement du neurone, ne permet pas le bon transport axonal, comprime le neurone et provoque sa mort.
Pendant un certain temps, la perte de fonction des neurones est compensée par la plasticité des neurones non atteints. De ce fait, la démence n’apparaît que lorsque la compensation ne peut plus être assurée.
 Fibrose ou sclérose35
Fibrose ou sclérose35
La fibrose est l’augmentation de la quantité des composants macromoléculaires de la matrice extracellulaire dans un tissu, dans un organe, avec un retentissement fonctionnel plus ou moins important. La matrice extracellulaire désigne l’ensemble de macromolécules extracellulaires du tissu conjonctif et des autres tissus. Elle est constituée en grande partie de glycoprotéines – comme le collagène – et de protéines pures telle l’élastine, ainsi que de glycosaminoglycannes, sorte de gel dans lequel baignent les cellules. L’augmentation des éléments de la matrice extracellulaire comme le cytosquelette en diminue la plasticité, le tissu devient dur et perd progressivement sa fonctionnalité.
Cependant en pratique, actuellement, les deux termes « fibrose » et « sclérose » peuvent être considérés comme synonymes36.
La fibrose est principalement une anomalie quantitative des macromolécules (de structures fibrillaires le plus souvent) de la matrice extracellulaire qui s’accumulent dans les tissus et organes atteints. Le développement de la fibrose fait intervenir deux mécanismes : d’une part l’augmentation de synthèse des macromolécules matricielles et, d’autre part, la diminution de leur dégradation. La fibrose, par accumulation de matrice extracellulaire, résulte ainsi d’un déséquilibre entre la synthèse et la dégradation. Quelle que soit son étiologie, elle apparaît étroitement liée aux processus moléculaires et cellulaires de la réaction inflammatoire chronique, y compris dans des fibroses d’origine métabolique ou d’origine circulatoire. Au final, le tissu devenu fibreux perd son élasticité, sa compliance37 et donc de sa fonctionnalité globale.
La fibrose se traduit par une dureté du tissu concerné (à l’origine le terme sclérose est un terme macroscopique et le terme fibrose est un terme microscopique)38.
– Une sclérose est hyaline si elle est ancienne et homogène, de coloration éosinophile.
– Une sclérose atrophique remplace un tissu spécialisé en le rétractant (cicatrice).
– Une sclérose est hypertrophique quand, au contraire, elle entraîne une augmentation du tissu concerné.
– Une sclérose est systématisée lorsqu’elle se développe le long des axes conjonctivo-vasculaires d’un tissu ou d’un organe.
– Une sclérose est mutilante quand elle détruit l’architecture normale (ex-cirrhose hépatique).
– Une sclérose d’enkystement entoure une zone ou un foyer inflammatoire (abcès). Une fibrose est inflammatoire lorsqu’elle contient des cellules inflammatoires nombreuses (il s’agit généralement d’une inflammation récente).
– Une fibrose est dystrophique lorsqu’elle ne contient que d’exceptionnelles cellules inflammatoires et que les fibres collagènes sont nombreuses et denses.
Les modifications qualitatives conduisent à la dégénérescence cellulaire puis à la mort (nécrose cellulaire). La dégénérescence cellulaire est le terme de la diminution des métabolismes cellulaires avec arrêt complet de certains d’entre eux. Les lésions qu’elle entraîne sont réversibles, jusqu’à un certain point, mais aboutissent souvent à la nécrose et donc à la mort cellulaire39.
• Dégénérescence hydropique (ou vacuolaire), lipidique, granuleuse, du cytoplasme fondamental, dégénérescence cireuse par disparition des myofibrilles.
• La fibrose interstitielle diffuse pulmonaire est une affection caractérisée par un désordre anatomique de type sclérose prédominant au niveau de la paroi alvéolo-capillaire. Elle entraîne des anomalies ventilatoires restrictives et une baisse de l’hématose par diminution de la capacité de diffusion des gaz. En l’absence de cause identifiée, on parle de fibrose pulmonaire idiopathique.
• La sclérose en plaques est une affection dégénérative du système nerveux central. Elle se caractérise par un processus de démyélinisation localisée dans la substance blanche aboutissant à la constitution de plaques de sclérose. Elle évolue par poussées successives plus ou moins régressives survenant à intervalles irréguliers dont la durée est imprévisible.
Lors des poussées, la myéline qui entoure le nerf est détruite à certains endroits, ce qui altère la transmission de l’influx nerveux : diminution de la rapidité.
Les causes de la sclérose en plaques ne sont aujourd’hui pas encore complètement élucidées. Néanmoins, certains facteurs ont été identifiés tels des facteurs génétiques ou environnementaux. Ces facteurs, associés à un agent déclencheur – probablement infectieux – permettraient de générer un processus auto-immun spécifiquement dirigé vers les gaines de myéline qui entourent les fibres nerveuses.
• La fibrose myocardique40 est l’un des acteurs principaux de la morbimortalité liée à l’insuffisance cardiaque. Qu’elle soit systématisée ou diffuse comme dans la myocardiopathie primitive, elle est à l’origine des troubles du rythme ventriculaire favorisés par des troubles électrolytiques d’une rigidité ventriculaire responsable d’une restriction myocardique source d’œdème pulmonaire et de surmortalité. Enfin, la fibrose participe à la genèse des troubles conductifs intraventriculaires par disjonction cellulaire qui se traduit par la survenue d’un bloc de branche gauche et d’un asynchronisme de contraction. La fibrose diminue la contraction ventriculaire qui entraîne à son tour une augmentation de la pré-charge.
 Modifications qualitatives liées à la mort cellulaire
Modifications qualitatives liées à la mort cellulaire
 Apoptose
Apoptose
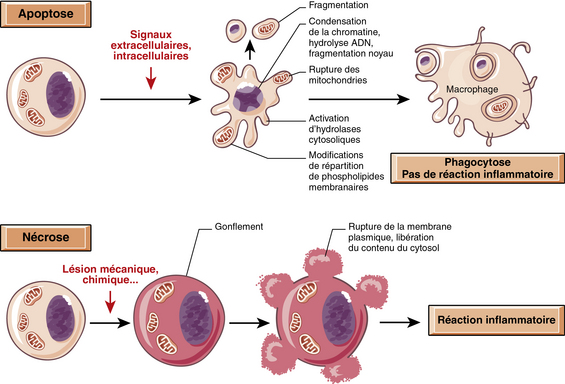
L’apoptose ou mort cellulaire programmée est un processus actif dépendant de l’expression de gènes spécifiques conduisant à l’autodestruction cellulaire. Ce phénomène fait partie de divers processus physiologiques tels que l’embryogenèse ou le renouvellement des tissus.
L’apoptose est un processus actif, contrairement à la nécrose qui est subie par la cellule. Une cellule saine peut s’engager vers la mort suite à une induction, et ce dans le cadre du maintien de l’homéostasie.
Il existe trois phases dans ce mécanisme41 :
– une phase d’induction par signaux extra- ou intracellulaires (initiée par une période silencieuse) ;
– une phase effectrice comprenant un point de non-retour ;
– une phase très rapide et morphologiquement visible, phase de dégradation et phagocytose par la cellule voisine.
L’apoptose participe à l’homéostasie. Cependant, il existe une apoptose pathologique liée soit à une apoptose excessive, soit à un défaut d’apoptose42 (tableau 3.I).
Tableau 3.I Maladies et apoptose
| Maladies associées à un défaut d’apoptose | Maladies associées à un excès d’apoptose |
|---|---|
| Cancers Lymphome folliculaire Carcinome avec mutation du gène p53 Tumeurs hormono-dépendantes (cancers du sein, des ovaires et de la prostate) Maladies auto-immunes Lupus érythémateux disséminé |
Maladies neurodégénératives Maladie d’Alzheimer Maladie de Parkinson Sclérose Latérale Amyotrophique (SLA) SIDA Ischémies : Hépatites fulminantes |
Les mécanismes de l’apoptose et de la nécrose sont résumés dans le schéma ci-après (figure 3.7).
 Nécrose
Nécrose
La nécrose cellulaire se définit par l’arrêt des processus de synthèse avec coagulation irréversible des constituants cellulaires. Elle aboutit à la mort de la cellule43. La nécrose est une mort cellulaire dite « accidentelle » qui survient lors d’un dommage tissulaire d’origine chimique ou physique et qui implique des groupes de cellules. Lors de la nécrose, la cellule devient turgescente, puis la membrane cellulaire éclate déversant le contenu cellulaire dans les tissus environnants, provoquant localement une inflammation. Cette inflammation est due à la présence d’enzymes lysosomiales du cytoplasme. Néanmoins, les organelles (notamment les mitochondries et le noyau) restent intactes tout au long de ce processus.
Les premières étapes d’un processus de nécrose cellulaire sont réversibles. Cependant, le point de non-retour est atteint lorsqu’il existe une perte des propriétés de perméabilité sélective de la membrane cytoplasmique. La lyse cellulaire s’accompagne alors du relargage des enzymes lysosomiales dans le milieu extracellulaire, provoquant ainsi une réaction inflammatoire qui vise à éliminer les « déchets » ainsi produits. Ce phénomène accélère la lyse cellulaire des cellules environnantes. De ce fait, in vivo, la nécrose s’accompagne de phénomènes inflammatoires importants facilitant son identification.
La nécrose donne finalement l’image d’un phénomène anarchique et désordonné, tandis que l’apoptose est un processus actif et bien contrôlé d’implosion cellulaire.
![]() Exemple de mécanisme physiopathologique
Exemple de mécanisme physiopathologique
L’arthrose
Elle n’est pas une simple usure du cartilage mais un processus actif impliquant toute l’articulation. Si la suppression des propriétés biomécaniques et biologiques du cartilage articulaire est reconnue comme élément majeur de la physiopathologie de l’arthrose, la destruction arthrosique du cartilage est le résultat d’un déséquilibre entre anabolisme et catabolisme de la matrice extracellulaire. Ce déséquilibre est accentué par une apoptose chondrocytaire accélérée et par la participation du tissu synovial à l’activation chondrocytaire par libération de nombreux médiateurs. Enfin l’os sous-chondral pourrait participer aux phénomènes de dégradation de la matrice probablement par le biais d’une sécrétion d’enzymes protéolytiques par les cellules osseuses44. Lorsque la lésion est réelle, l’évolution naturelle est la cicatrisation fibreuse cartilagineuse45 avec formation de corps apoptoïques, qui du fait de l’absence de cellules phagocytaires dans le cartilage s’accumulent et se calcifient in situ, pérennisant le dysfonctionnement chondrocytaire46.
44 http://www.rhumato.info/Physiopatharthrose.htm
45 http://www.books.google.fr/books?id=K4AsfjPH5okC&pg=PA224&lpg=PA224&dq=processus+d%C3%A9g%C3%A9n%C3%A9ratif+%C3%A9tiologies+traumatisme&source=bl&ots=8qCwbQ7cM1&sig=rqy6ON6k11ZDTEc4eyQD5l62e3w&hl=fr&ei=HFDlTPX7Jsip4AaQtIXwDg&sa=X&oi=book_result&ct=result&resnum=3&ved=0CCQQ6AEwAg#v=onepage&q&f=false
46 http://www.ephe.univmontp2.fr/site_html/Site%20EPHEAUF/monographies_html/manuscrits/biol_cell&mol_html/dip_etienne_pcm04.htm#_Toc72138681
DÉGÉNÉRESCENCE
 Définition
Définition
La dégénérescence est un processus de dégradation totale ou partielle d’une cellule, d’un tissu, d’un organe. Les cellules se modifient, perdent leurs caractéristiques spécifiques et leur fonctionnalité pour se transformer en une entité « inerte ».
La dégénérescence cellulaire est l’ensemble des lésions élémentaires cellulaires, réversibles, pouvant précéder l’apparition de modifications cellulaires irréversibles correspondant à la nécrose. Les lésions réversibles sont principalement liées à des perturbations métaboliques, elles peuvent donc régresser et conduire à un retour à l’état antérieur. La nécrose peut être précédée de lésions réversibles, dites lésions dégénératives.
La dégénérescence « chronique » s’inscrit dans le temps. Elle est souvent liée au vieillissement normal. Il s’agit d’une réduction des réserves adaptatives, conduisant à un risque de déséquilibre en cas de survenue d’un phénomène aigu. La dégénérescence peut concerner une fonction particulière, comme par exemple la fonction de reproduction qui s’arrête à un moment donné de la vie de l’individu. Cependant, elle peut survenir prématurément. Dans ce cas, elle est souvent liée à une utilisation excessive d’un tissu ou d’un organe (comme dans le sport de haut niveau par exemple) ou à une détérioration des structures, entraînant une altération de la fonction suite à l’exposition à des facteurs favorisants.
 Types de dégénérescences
Types de dégénérescences
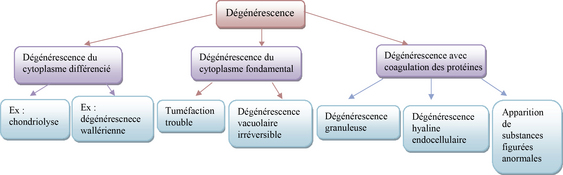
Il existe plusieurs sortes de dégénérescences selon le type de cellules concernées (figure 3.8).
La dégénérescence wallérienne, consécutive à l’interruption physique d’un axone par section, se caractérise par la dégénérescence de l’axone et de sa gaine de myéline en aval de la section, dégénérescence qui progresse dans le sens cellulifuge. La régénérescence est d’installation rapide, mais lente (1 mm/24 heures) et le plus souvent incomplète. Il s’agit d’une repousse du cylindraxe à partir du bout central et sa qualité dépend de la qualité de la gaine de myéline restante, de la qualité des tissus environnants et du mécanisme initial de lésion. Lorsque le corps cellulaire d’un neurone est détruit, la fibre nerveuse dégénère totalement.
Elle se traduit par un allongement du temps de conduction des nerfs périphériques, elle est à l’origine d’une diminution de la sensibilité proprioceptive (hypopalliesthésie) qui favorise l’instabilité posturale. La dégénérescence du système nerveux autonome se caractérise par une réduction de la réponse aux stimulations en raison d’une diminution de sensibilité des récepteurs aux catécholamines.
La dégénérescence du muscle squelettique se traduit au plan cellulaire par une diminution de la densité en fibres musculaires, ce qui a pour conséquence une réduction de la masse musculaire ou sarcopénie. Au plan fonctionnel, on constate une diminution de la force musculaire rendant l’adaptation à l’effort plus difficile, voire impossible.
La dégénérescence osseuse ou arthrose se caractérise par la réduction de la densité minérale osseuse ou ostéopénie. Le squelette se fragilise rendant le risque de fracture plus élevé, la résistance mécanique de l’os diminuant. Sur le plan physiologique, la femme est protégée tant qu’elle produit des œstrogènes, puis à partir de la ménopause, elle devient plus sensible à cette dégénérescence.
Au total, la dégénérescence résulte d’altérations cellulaires qui entraînent à leur tour une modification des tissus comme le remodelage ou la perte tissulaire qui seront responsables à leur tour de l’apparition d’insuffisances organiques et d’incapacités fonctionnelles empêchant l’organisme de s’adapter aux besoins.
 Conséquences
Conséquences
Les principales conséquences de la dégénérescence acquise sont le remodelage ou remaniement tissulaire, la perte cellulaire.
 Remaniement tissulaire ou remodelage
Remaniement tissulaire ou remodelage
Il correspond à l’adaptation permanente du tissu aux besoins de l’organe, tissus en cours de réparation suite à l’exposition à des facteurs favorisants, responsables de lésions cellulaires. Il se traduit différemment selon les organes. Il peut être lié au processus inflammatoire qui l’accompagne. Il touche principalement les organes tels que le foie, le cœur, le poumon.
Pour le cœur, le mécanisme initiateur est soit génétique ou acquis, chronique ou aigu, par surcharge en pression ou destruction myocytaire. Ce remodelage est une réponse à l’agression myocardique, il concerne le ventriculaire gauche.
La réparation d’un tissu organique est un phénomène universel afin d’assurer la survie de l’individu. Au niveau cardiaque, les mécanismes adaptifs sont fonctionnels ou hémodynamiques avec la conservation d’un débit et d’une pression artérielle compatible avec la vie, et tissulaires, peu différents des autres organes, marqués par l’inflammation, le dépôt de collagène et l’hypertrophie des cellules viables adjacentes.
Les cardiomyocytes, cellules hautement différenciées, sont incapables de se diviser et l’apoptose, phénomène fréquent au sein du myocarde, majore la perte des unités contractiles « saines » et aggrave la dysfonction cardiaque. On distingue deux types de réponse. La première, de type dilatation ventriculaire, caractérise les surcharges en volume (insuffisance aortique et insuffisance mitrale) et la cardiopathie ischémique. La seconde, de type hypertrophie myocardique, est la particularité des surcharges en pression (rétrécissement aortique et hypertension artérielle). C’est une étape de transition avant la dilatation ventriculaire. Le remodelage, qui se veut un phénomène de réparation et d’adaptation à l’agression myocardique, va rapidement dépasser son but et aggraver l’insuffisance cardiaque.
 Perte cellulaire
Perte cellulaire
La perte cellulaire est liée au processus d’apoptose, qui à un moment donné devient supérieur au processus de formation cellulaire, ou de nécrose cellulaire. Elle se traduit par une diminution du volume de l’organe le plus souvent, mais pas toujours (exemple le cœur).
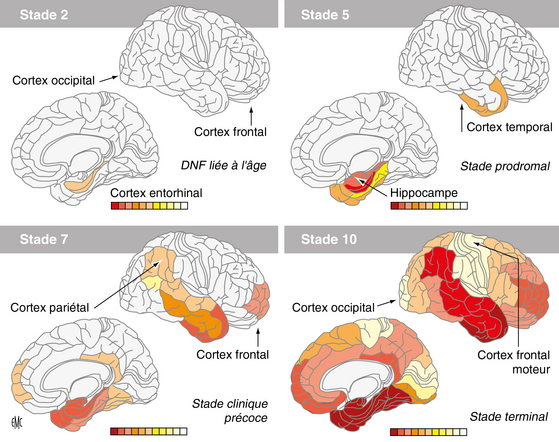
Progression séquentielle de la pathologie Tau au cours du vieillissement et de la maladie d’Alzheimer (MA) : la localisation et l’intensité du processus dégénératif visualisé par l’agrégation
 La perte neuronale
La perte neuronale
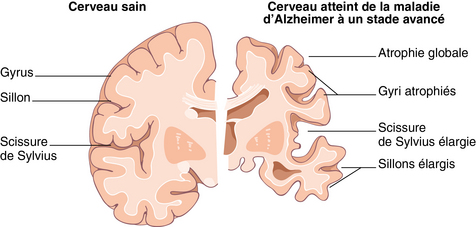
Elle concerne majoritairement le cortex. La perte neuronale, consécutive à la mort de nombreuses cellules, est la conséquence des anomalies intra- et extra-neuronales (présence de neurofibrilles et plaque amyloïde ; cf. chapitre 2). Elle se manifeste par une atrophie du cerveau. Celle-ci est variable selon les cas et peut parfois être très importante (figure 3.9).
La gliose réactionnelle
Une réaction gliale importante est observée parallèlement à la perte neuronale. Elle se traduit par la présence d’astrocytes47 hypertrophiques. On observe également une importante concentration de cellules microgliales, dont le rôle est de phagocyter les lésions cérébrales et de participer à la réaction inflammatoire. Au total, la dégénérescence neuronale aboutit au remplacement des neurones par un tissu de comblement cicatriciel dérivé de la névroglie.
47 Le rôle des astrocytes est dans ce cas de phagocyter les neurones morts.
des protéines Tau sous forme de dégénérescence neurofibrillaire (DNF) sont représentées par les différentes cartants. On peut noter que la pathologie Tau s’installe systématiquement dans la région entorhinale (stade 2), puis hippocampique (stade 3 non représenté), au cours du vieillissement cérébral. Au cours de la MA, la pathologie Tau remonte les connexions neuronales pour progresser dans d’autres régions, selon un chemin précis, invariable, hiérarchique. On la trouvera dans le cortex temporal des patients ayant des troubles cognitifs légers (Mild Cognitive Impairment : MCI) (stade 5). Au stade MCI, la présence de dépôts amyloïdes démontrera que le patient était au stade prodromal de la MA. Les signes cliniques de MA apparaissent lorsque les régions néocorticales associatives sont affectées (pôle frontal, cortex pariétal, cortex temporal supérieur) (stade 7 à stade 10 ; cf. figure 3.10).
Le remaniement tissulaire ou la perte tissulaire se traduisent par l’apparition d’insuffisances organiques ou fonctionnelles qui peuvent aboutir à des défaillances. Généralement, les insuffisances se développent dans la durée et présentent volontiers un aspect chronique (traité en première partie de l’ouvrage), alors que les défaillances apparaissent plus ou moins brutalement et présentent plutôt un aspect aigu. Elles seront développées dans la deuxième partie de l’ouvrage.
S’ENTRAÎNER
VÉRIFIER SES CONNAISSANCES
CROC
I. Compléter le schéma suivant (schéma 1).
II. Définir les termes suivants : atrophie, hyperplasie, infiltration, dégénérescence.
III. Indiquer quels sont les deux types d’anomalies identifiés dans la maladie d’Alzheimer.
IV. Cocher la réponse exacte :
1. L’infiltration correspond à la présence d’une substance habituellement présente dans la cellule V F
2. L’infiltration correspond à la présence d’une substance anormale dans la cellule V F
3. La présence d’amyloïde dans une cellule correspond à une infiltration V F
4. La présence d’amyloïde dans une cellule correspond à une surcharge V F
5. La fibrose correspond à une diminution de la quantité des composants macrocellulaires de la matrice extra-cellulaire V F
6. La fibrose correspond à une augmentation de la quantité des composants macrocellulaires à l’intérieur de la cellule de la matrice extra-cellulaire V F
7. L’hypertrophie correspond à l’augmentation du volume d’une cellule V F
8. L’hypertrophie correspond à l’augmentation du nombre de cellules V F
9. L’hypoplasie correspond à la diminution de l’activité formatrice des tissus V F
10. L’hypoplasie correspond à la diminution du nombre de cellules V F
CORRIGÉ
VÉRIFIER SES CONNAISSANCES
CROC
I. Schéma complété (schéma 2)
II.. L’atrophie : c’est la diminution normalement réversible de la masse d’une cellule (après avoir atteint une maturité normale) en rapport avec une diminution de son activité. Elle se traduit par une réduction de sa taille et éventuellement la disparition de certains de ses constituants. Elle peut concerner les tissus et les organes et correspond alors à un défaut de nutrition des organes et des tissus, caractérisé par une diminution notable de leur volume et de leur poids. Elle est la conséquence d’une diminution du métabolisme cellulaire.
L’hyperplasie : correspond à la formation d’un tissu pathologique aux dépens d’un tissu sain, alors que les éléments néoformés ne diffèrent en rien, ni dans leur forme, ni dans leurs fonctions. C’est donc une hypertrophie organique par multiplication des cellules qui le constitue. L’hyperplasie signe une hyperactivité cellulaire, néanmoins, la multiplication cellulaire n’est pas anarchique comme c’est le cas dans un processus tumoral. Elle reste sous le contrôle des mécanismes de régulation de la prolifération cellulaire.
L’infiltration : correspond à un engorgement formé par la présence d’une substance anormale dans la cellule ou dans le tissu. Elle peut être d’origine liquidienne, graisseuse ou minérale. Elle peut être endogène ou exogène. L’infiltration, qu’elle soit endogène ou exogène entraîne toujours une diminution de la fonctionnalité et a pour conséquence un abaissement du métabolisme cellulaire.
La dégénérescence : c’est un processus de dégradation totale ou partielle d’une cellule, d’un tissu, d’un organe. Les cellules se modifient, perdent leurs caractéristiques spécifiques et leur fonctionnalité pour se transformer en une entité « inerte ». C’est l’ensemble des lésions élémentaires cellulaires, réversibles, pouvant précéder l’apparition de modifications cellulaires irréversibles correspondant à la nécrose.
III.. Dans la MA, on distingue deux processus dégénératifs distincts à l’origine des lésions : l’amyloïdogenèse (infiltration exogène) et la dégénérescence neurofibrillaire (DNF) liée à une surcharge en protéine Tau. Cela se traduit par la présence de deux types de lésions cérébrales, les plaques amyloïdes extracellulaires et l’accumulation intraneuronale de fibrilles (formées de filaments caractéristiques) en abondance dans la substance grise du néocortex.