Chapitre 7 Généralités sur les tumeurs
 Connaître la définition, la composition et la classification des tumeurs.
Connaître la définition, la composition et la classification des tumeurs.
 Connaître les principaux paramètres permettant d’évaluer le pronostic des tumeurs.
Connaître les principaux paramètres permettant d’évaluer le pronostic des tumeurs.
 Connaître les techniques histologiques et moléculaires utiles au diagnostic des tumeurs.
Connaître les techniques histologiques et moléculaires utiles au diagnostic des tumeurs.
 Maîtriser les stratégies permettant de réaliser le diagnostic d’une tumeur.
Maîtriser les stratégies permettant de réaliser le diagnostic d’une tumeur.
La classification des tumeurs est fondée sur leur organe ou tissu d’origine, leur type histologique, et leur degré de malignité. Le diagnostic est fondé sur l’histologie, mais fait de plus en plus souvent appel à des techniques complémentaires telles que l’immunohistochimie, la cytogénétique et la biologie moléculaire.
Définition d’une tumeur
Le terme « tumeur » désignait autrefois toute augmentation localisée de volume déformant un organe ou une partie du corps. Elle réunissait des lésions différentes, notamment :
• des collections liquidiennes collectées dans une cavité préformée ;
• des tuméfactions d’origine inflammatoire ;
• des hypertrophies tissulaires d’origine dystrophique (goitre) ;
• des lésions liées à des désordres d’origine embryologique (dysembryoplasies).
La définition actuelle est plus restrictive et repose sur la notion d’homéostasie des tissus.
Le développement et la croissance d’un tissu ou d’un organe sont conditionnés par des processus complexes permettant la régulation des différentes étapes de la vie d’une cellule : la prolifération, la différenciation, la sénescence et la mort cellulaire programmée. Tous ces phénomènes sont aussi mis en jeu lors du renouvellement des cellules dont la durée de vie est limitée. Au sein d’un tissu, l’équilibre entre ces processus est à l’origine de l’homéostasie tissulaire. Les anomalies de cette homéostasie, par augmentation de la prolifération et/ou diminution de la mort cellulaire, sont à l’origine de l’accumulation des cellules aboutissant à la formation d’une tumeur macroscopiquement visible.
Le terme de tumeur (synonyme : « néoplasme » ou « néoplasie ») désigne actuellement une prolifération cellulaire excessive aboutissant à une masse tissulaire ressemblant plus ou moins au tissu normal homologue (adulte ou embryonnaire), ayant tendance à persister et à croître, témoignant de son autonomie biologique.
Caractères d’une tumeur
Prolifération cellulaire excessive
La prolifération est liée à la multiplication des descendants d’une ou plusieurs cellules anormales. C’est la notion de clonalité. Un clone est un ensemble de cellules dérivées d’une seule cellule initiale. Une tumeur est dite poly- oligo- ou monoclonale, selon qu’elle se développe à partir de plusieurs, quelques ou une seule cellule.
Masse tissulaire ressemblant plus ou moins à un tissu normal
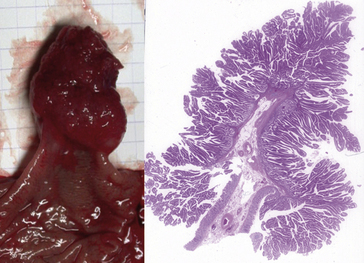
Les caractères cytologiques et architecturaux de ce nouveau tissu réalisant un aspect plus ou moins proche de celui du tissu normal homologue adulte ou embryonnaire. Cette ressemblance définit une notion fondamentale : la différenciation tumorale. Plus la fonction et la structure tumorales se rapprochent de la fonction et de la structure du tissu normal, plus la tumeur est dite différenciée (figure 7.1).
Tendance à persister et à croître
La prolifération tumorale se poursuit après la disparition du « stimulus » qui lui a donné naissance. La prolifération tumorale est biologiquement autonome.
Succession d’événements génétiques
Ces anomalies génétiques s’accumulent généralement en plusieurs années. Au cours de ce processus en plusieurs étapes, le génome des cellules tumorales acquiert des allèles mutants de proto-oncogènes, de gènes suppresseurs de tumeur et de gènes contrôlant directement ou indirectement l’intégrité de l’ADN.
La conséquence de ces anomalies génétiques est l’acquisition de nouvelles propriétés, dont la capacité :
Composition d’une tumeur
Le tissu tumoral est constitué :
• de cellules tumorales : cellules prolifératives anormales ;
• d’un tissu de soutien (= stroma tumoral) fait de cellules et de substance extra-cellulaire dans laquelle est située la vascularisation tumorale. Les cellules du stroma ne présentent pas les anomalies génétiques des cellules tumorales.
Types histologiques des tumeurs
Les différentes composantes de chaque tumeur (cellules tumorales et stroma) peuvent présenter des aspects morphologiques particuliers qui peuvent être regroupés par types histologiques. Les tumeurs sont ainsi classées en fonction de critères histologiques communs, définis par les classifications internationales, éditées par l’Organisation mondiale de la santé (OMS), et remises à jour régulièrement. La reconnaissance de ces critères et le classement de la tumeur dans le type adéquat sont la base du diagnostic anatomopathologique de toute tumeur.
En pratique, les tumeurs sont classées en fonction de l’organe dont elles dérivent (ex : sein, foie, rein, os), (figure 7.2), puis en fonction de leur type histologique. Le type histologique correspond à la cellule normale dont la tumeur semble dériver.
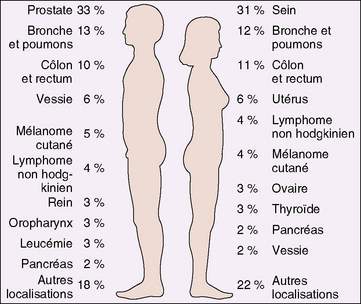
Figure 7.2 Incidence des cancers par localisation et sexe. Estimations 2006, sans prendre en compte les carcinomes basocellulaires et spinocellulaires cutanés, ni les carcinomes in situ (sauf ceux de la vessie).
(Adapté d’après Jemal A, et al. : Cancer statistics, 2006. CA Cancer J Clin 56 : 106, 2006)
Au sein d’un même organe, les différents types histologiques de tumeur peuvent avoir une évolutivité particulière, un mode d’extension préférentiel et une réponse variable suivant les traitements. Les traitements sont donc adaptés en fonction du type histologique de chaque tumeur. Ainsi, bien que dans certains organes un type de tumeur soit nettement prépondérant (ex : les adénocarcinomes représentent 95 % des tumeurs malignes du sein), un autre type histologique de tumeur (ex : un lymphome ou un angiosarcome) peut s’y développer et nécessitera un traitement radicalement différent. De plus, certains types de tumeurs peuvent être héréditairement transmissibles et justifier une enquête génétique, d’autres sont des maladies professionnelles (ex : exposition à l’amiante et mésothéliome).
Différenciation tumorale
Le tissu tumoral tend à reproduire la structure et la fonction d’un tissu normal :
• soit le plus souvent, l’aspect du tissu dont les cellules tumorales sont originaires ;
• soit plus rarement un tissu différent : la tumeur est dite métaplasique.
Exemple : l’épithélium bronchique est bordé d’un épithélium cylindrique cilié. Les tumeurs bronchiques peuvent être des tumeurs à différenciation glandulaire ou des tumeurs à différenciation malpighienne lorsqu’elles surviennent sur une métaplasie malpighienne de l’épithélium bronchique.
La différentiation d’une tumeur est sa tendance à ressembler à un tissu normal ou embryonnaire. La tumeur est dite :
• bien différenciée, lorsqu’elle ressemble nettement et de façon homogène au tissu normal ;
• peu différenciée lorsque la ressemblance est lointaine ou focale ;
• indifférenciée, ou anaplasique (ex : carcinome indifférencié défini comme une tumeur à différenciation épithéliale dont il est impossible de préciser la différenciation glandulaire ou malpighienne) (figure 7.3).
Tumeurs bénignes et malignes
Contrairement aux tumeurs bénignes, les tumeurs malignes aboutissent spontanément à la mort du patient. Cette distinction importante sur le plan évolutif est fortement corrélée à des critères macroscopiques et histologiques.
Tumeurs bénignes
Caractères évolutifs
Les tumeurs bénignes se développent localement et restent cantonnées au tissu dans lequel elles ont pris naissance. Leur croissance est lente. Toutefois, elles peuvent atteindre un volume et un poids importants. Elles ne récidivent pas après ablation chirurgicale, à condition que l’exérèse soit complète. Ces tumeurs ne métastasent jamais. Leur évolution est généralement favorable. Toutefois, dans certains cas, elles peuvent être la cause de complications graves voire mortelles, en raison de leur siège ou de désordres métaboliques.
• un méningiome du trou occipital, situé dans un orifice non expansible, peut avoir une évolution mortelle en provoquant un engagement du tronc cérébral à travers l’orifice occipital ;
• un adénome parathyroïdien est responsable d’une hyperparathyroïdie et par conséquent d’une hypercalcémie parfois dangereuse.
Caractères macroscopiques
Il s’agit de tumeurs circonscrites, bien limitées, nettement séparées des tissus avoisinants, parfois même entourées par une capsule (coque faite de tissu conjonctif). Cette limitation explique la facilité de l’exérèse chirurgicale et la possibilité d’une exérèse limitée à la seule tumeur (ex : adénofibrome du sein, léiomyome de l’utérus).
Caractères histologiques
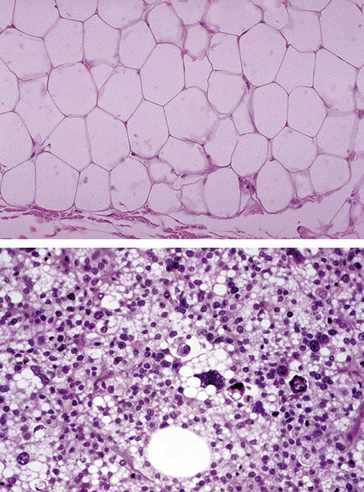
Le tissu tumoral reproduit de très près la structure du tissu initial (tumeur différenciée). Les cellules ont une morphologie normale et ne présentent aucun caractère de malignité (figure 7.4).
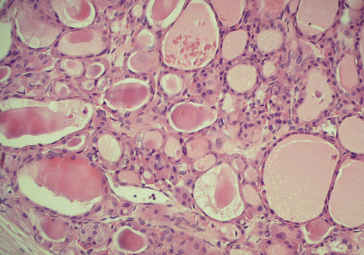
Figure 7.4 Tumeur bénigne : adénome de la thyroïde. L’histologie est très proche de celle observée dans le parenchyme thyroïdien normal.
Il n’y a pas d’envahissement des tissus voisins. Les tumeurs bénignes refoulent sans les détruire les tissus sains de voisinage : elles sont expansives (ex : adénome du foie).
Tumeurs malignes
Les caractères des tumeurs malignes ou cancers s’opposent point par point à ceux des tumeurs bénignes (tableau 7.1).
Tableau 7.1 Tableau récapitulatif tumeurs bénignes/malignes.
| Tumeurs bénignes | Tumeurs malignes |
|---|---|
| Bien limitée | Mal limitée |
| Encapsulée | Non encapsulée |
| Histologiquement semblable au tissu d’origine (bien différenciée) | Différenciation variable (de bien à peu ou pas semblable au tissu d’origine) |
| Cellules régulières | Cellules cancéreuses (anomalies du cytoplasme et du noyau) |
| Croissance lente | Croissance rapide |
| Refoulement sans destruction des tissus voisins | Envahissement des tissus voisins |
| Pas de récidive locale après exérèse complète | Exérèse complète difficile. Récidive possible après exérèse supposée complète |
| Pas de métastase | Métastases |
Caractères évolutifs
Les tumeurs malignes ont habituellement une croissance rapide. Elles donnent naissance à une dissémination tumorale à distance (surtout par voie lymphatique et sanguine) avec éclosion et développement de tumeurs secondaires dans d’autres viscères : les métastases. Les tumeurs malignes ont tendance à récidiver après éradication locale. L’évolution, en l’absence de traitement, se fait spontanément vers la mort.
Limites de la distinction bénin/malin
Les caractères opposant les tumeurs bénignes et les tumeurs malignes constituent un schéma valable dans la plupart des cas. Toutefois, il est des cas où les critères morphologiques ne correspondent pas à l’évolution.
Continuum entre certaines tumeurs bénignes et tumeurs malignes
Adénomes coliques et adénocarcinomes coliques, tumeurs urothéliales papillaires, astrocytomes, tumeurs papillaires du rein. Ce continuum appelé « progression tumorale » correspond à l’acquisition progressive par la tumeur d’un phénotype de malignité, d’anomalies chromosomiques et géniques en nombre croissant.
Tumeurs d’agressivité locale
Caractères histologiques bénins contrastant avec une infiltration des tissus avoisinants et une tendance à la récidive en raison des difficultés de l’exérèse (ex : les fibromatoses).
Tumeurs à malignité locale
Tumeur dont les caractères histologiques et macroscopiques sont malins mais dont l’agressivité est locale. Le pronostic est plus favorable que ne le laisserait supposer le caractère infiltrant de la tumeur (ex : carcinome basocellulaire de la peau).
Les critères macroscopiques et microscopiques d’une tumeur ne permettent parfois pas d’en affirmer la nature bénigne ou maligne (ex : tumeurs endocrines bien différenciées). Dans certains cas, cette nature maligne ne peut être affirmée que par la survenue de métastases (ex : phéochromocytome).
Nomenclature des tumeurs
L’examen anatomopathologique d’une tumeur a pour objectif d’établir le type, le grade histologique et le stade (c’est-à-dire l’extension) et d’évaluer le pronostic ; ce qui contribue à déterminer le traitement le plus approprié pour le patient.
La nomenclature des tumeurs suit une terminologie précise (tableaux 7.2–7.7). Un nom de tumeur se compose généralement d’une racine et d’un suffixe, et peut être associé à un adjectif. La racine définit la différenciation (adéno désigne une tumeur glandulaire, rhabdomyo une tumeur musculaire striée, leiomyo une tumeur musculaire lisse).
Tableau 7.2 Classification de quelques tumeurs épithéliales.
| Cellule ou tissu d’origine | Tumeur bénigne | Tumeur maligne |
|---|---|---|
| Épithélium malpighien | Papillome malpighien | Carcinome épidermoïde |
| Épithélium urothélial | Papillome urothélial | Carcinome urothélial* |
| Épithélium glandulaire | Adénome | Adénocarcinome |
* Dans certains cas, la tumeur est de très bon pronostic, peu agressive : on utilise alors le terme de tumeur urothéliale de faible potentiel de malignité.
Tableau 7.3 Classification de quelques tumeurs conjonctives.
| Cellule ou tissu d’origine | Tumeur bénigne | Tumeur maligne |
|---|---|---|
| Fibroblastes | Fibrome | Fibrosarcome |
| Cellules musculaires lisses | Leiomyome | Leiomyosarcome |
| Cellules musculaires striées | Rhabdomyome | Rhabdomyosarcome |
| Adipocytes | Lipome | Liposarcome |
| Cellules endothéliales | Angiome | Angiosarcome |
| Cellules cartilagineuses | Chondrome | Chondrosarcome |
| Cellules osseuses | Ostéome | Ostéosarcome |
Tableau 7.4 Classification de quelques tumeurs des tissus hématopoïétiques.
| Cellule ou tissu d’origine | Tumeur bénigne | Tumeur maligne |
|---|---|---|
| Lymphocytes | Lymphomes Leucémies aiguës lymphoblastiques |
|
| Myéloïdes | Syndromes myéloprolifératifs chroniques Leucémies aiguës myéloïdes |
Tableau 7.5 Classification de quelques tumeurs dérivées d’autres tissus.
| Cellule ou tissu d’origine | Tumeur bénigne | Tumeur maligne |
|---|---|---|
| Mélanocyte | Nævus nævocellulaire | Mélanome |
| Mésothélium | Mésothéliome bénin | Mésothéliome malin |
| Tissu méningé | Méningiome | Méningiome malin |
| Nerf périphérique | Schwannome | Tumeur maligne des gaines nerveuses périphériques |
| Cellules gliales | Astrocytome* | Glioblastome |
* Les astrocytomes véritablement bénins sont rares ; la plupart des tumeurs gliales astrocytaires ou oligodendrocytaires sont des tumeurs malignes mais avec des degrés variables d’agressivité. Le glioblastome, toujours malin, correspond au plus haut grade de malignité des tumeurs gliales.
Tableau 7.6 Classification des tumeurs du tissu germinal et des annexes embryonnaires.
| Cellule ou tissu d’origine | Tumeur bénigne | Tumeur maligne |
|---|---|---|
| Gonies | Séminome | |
| Sac vitellin | tumeur vitelline | |
| Placenta | Mole hydatiforme | Choriocarcinome |
| Disque embryonnaire | Carcinome embryonnaire | |
| Complexes (pluritissulaire) | Tératome mature | Tératome immature (malin) |
Tableau 7.7 Classification de quelques tumeurs du blastème embryonnaire.
| Tissu embryonnaire | Tumeur bénigne | Tumeur maligne |
|---|---|---|
| Nerveux | Neuroblastome | |
| Renal | Néphroblastome | |
| Hépatique | Hépatoblastome |
• ome est utilisé pour nommer les tumeurs bénignes (adénome, rhabdomyome, leiomyome). Il existe cependant des exceptions (ex : les lymphomes et les mélanomes sont des tumeurs malignes) ;
• matose désigne la présence de tumeurs multiples ou diffuses (angiomatose, leiomyomatose, adénomatose) ;
• carcinome désigne une tumeur maligne épithéliale (ex : adénocarcinome) ;
• sarcome désigne une tumeur maligne conjonctive (ex : rhabdomyosarcome) ;
• blastome désigne une tumeur embryonnaire (ex : néphroblastome ou neuroblastome).
Évaluation du pronostic des cancers
La classification des tumeurs en fonction de l’organe d’origine et de leur type histologique fournit des informations importantes pour évaluer leur pronostic. Toutefois, d’autres paramètres permettent de préciser le potentiel évolutif. Il s’agit du degré de différenciation (grade) et du degré d’extension (stade) de la tumeur, ainsi que dans certains cas de marqueurs moléculaires.
Grade
Le grade d’un cancer se fonde sur des critères histologiques tels le degré de différenciation tumorale, l’activité mitotique, le degré d’atypies cyto-nucléaires ou l’extension de la nécrose. Il est défini différemment pour chaque type de tumeur (figure 7.5).
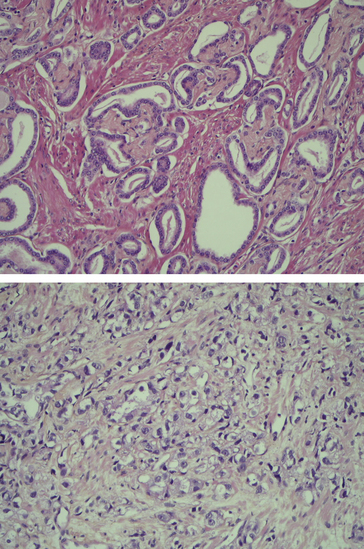
Figure 7.5 Le score de Gleason est important pour évaluer le pronostic des adénocarcinomes prostatiques. Ce score s’établit en additionnant le grade des 2 contingents tumoraux les plus abondants. Dans cet exemple grade 3 (en haut) + 5 (en bas) = score 8.
Exemple : le score de Scarff-Bloom-Richardson des adénocarcinomes mammaires prend en compte 3 variables : la différenciation glandulaire, les atypies cyto-nucléaires et le nombre de mitoses (comptées sur 10 champs au fort grossissement).
Stade
Le stade (ou degré d’extension) des cancers se fonde sur la taille de la tumeur primitive et/ou son extension aux tissus et organes de voisinage (T), l’importance de la dissémination aux ganglions lymphatiques régionaux (N) et la présence ou l’absence de métastases (M).
Le système de stadification TNM est actuellement le plus communément utilisé dans le monde. Chacune de ces trois lettres est suivie d’un chiffre variant de 0 (absent) à 4 au maximum, ou d’un X en cas d’impossibilité d’évaluation. Ces chiffres peuvent être suivis d’une lettre, qui apporte une précision supplémentaire. Le score est précédé de la lettre c si l’évaluation du stade est clinique ou de la lettre p si elle est faite par un pathologiste.
Exemple : adénocarcinome colique stade pT4aN1bMX, le pathologiste a détecté une infiltration tumorale de la séreuse et de 2 ou 3 ganglions, mais ignore s’il existe des métastases à distance. Le score TNM permet ensuite de déterminer le stade (ex : adénocarcinome colique T3N0M0 = stade IIA, ou T3N1aM0 = stade IIIB).
Après une résection chirurgicale, le stade d’une tumeur doit être complété par une évaluation de la qualité de la résection, qui est exprimée par la lettre R, suivie des chiffres 0 (exérèse complète), 1 (envahissement microscopique des limites) ou 2 (envahissement macroscopique des limites).
Si l’évaluation du stade est faite après un traitement (ex : radio- ou chimiothérapie), le score TNM est précédé de la lettre y. Par exemple, un adénocarcinome rectal réséqué après radiothérapie aura un score ypT0N1a s’il ne persiste plus de tumeur primitive identifiable et qu’un seul ganglion régional est envahi.
Les classifications du stade TNM sont actualisées régulièrement (la 7e édition date de 2009). Aussi, il est important d’indiquer le référentiel utilisé lorsque l’on indique le stade TNM d’une tumeur. Par exemple, un adénocarcinome de l’estomac ayant envahi la sous-séreuse était classé « T2b » selon la 6e édition, alors qu’il est maintenant classé « T3 » selon la 7e édition.
Pour plus d’informations, voir les compléments en ligne En savoir plus 7.1 ![]() : « Stade TNM », En savoir plus 7.2
: « Stade TNM », En savoir plus 7.2 ![]() : « La classification TNM des cancers du côlon » et En savoir plus 7.3
: « La classification TNM des cancers du côlon » et En savoir plus 7.3 ![]() : « Exemples de marqueurs pronostiques ».
: « Exemples de marqueurs pronostiques ».
En savoir plus 7.1
Stade TNM
N0 indique l’absence et un autre chiffre signifie la présence d’un envahissement ganglionnaire régional. En fonction des organes, la signification de ce chiffre peut varier :
• pancréas : N1 = envahissement ganglionnaire régional ;
• estomac : N1 à N3 idem, mais le chiffre augmente en fonction du nombre de ganglions envahis ;
• canal anal : N1 à N3 idem, mais le chiffre change en fonction de la localisation des ganglions envahis.
M0 signifie l’absence de métastases à distance tandis que M1 (et parfois M2) traduisent la présence de métastases à distance (avec parfois une appréciation de leur nombre).
En savoir plus 7.2
La classification TNM des cancers du côlon
Le niveau d’infiltration de la tumeur dans la paroi colique détermine le T.
• Tis : l’infiltration, si elle existe, ne dépasse pas la musculaire muqueuse.
• T1 : infiltration de la sous-muqueuse.
• T2 : infiltration de la musculeuse.
• T3 : infiltration de la sous-séreuse.
• T4 : infiltration de la séreuse ou d’un organe de voisinage.
En savoir plus 7.3
Exemples de marqueurs pronostiques
• Immunohistochimie : l’expression de Bcl2 a été corrélée à un mauvais pronostic des lymphomes B diffus à grandes cellules. L’expression de ALK a été corrélée à un bon pronostic des lymphomes T anaplasiques.
• Cytométrie en flux : l’aneuploïdie a été associée à un mauvais pronostic dans beaucoup de tumeurs
Exemple de marqueurs de sensibilité à un traitement :
• Immunohistochimie : l’expression des récepteurs à l’œstradiol et à la progestérone dans les adénocarcinomes du sein (traitement anti-œstrogène).
• FISH : l’absence d’amplification de Her2 est corrélée à une absence de réponse au traitement par l’herceptine dans les adénocarcinomes du sein.
• Biologie moléculaire : la présence d’une mutation de KIT est corrélée à une bonne réponse au traitement par l’Imatinib dans les tumeurs stromales digestives.
Marqueurs pronostiques
Le développement de nouvelles techniques, telles l’immunohistochimie, la cytométrie en flux, l’hybridation in situ en fluorescence (FISH), la biologie moléculaire, a permis de découvrir la valeur pronostique de certaines molécules, dont l’anomalie d’expression ou les altérations sont détectables au sein des tumeurs. Les exemples sont chaque jour plus nombreux. Ces marqueurs permettent soit de préciser le pronostic spontané, soit de prévoir une réponse à un traitement.
Méthodes diagnostiques des tumeurs
L’étude anatomopathologique a pour but de préciser :
1. la nature histologique de la tumeur ;
2. son agressivité potentielle ;
4. sa capacité à répondre à des traitements de plus en plus spécifiques.
Diagnostic morphologique
Le diagnostic cyto- ou histologique nécessite de disposer d’échantillons de bonne qualité, représentatifs de la tumeur et n’ayant pas subi d’altérations pendant leur prélèvement ou leur transport. Les différents modes de prélèvements sont détaillés dans le chapitre 1.
Examen des coupes histologiques
Lorsqu’elles sont colorées à l’HES constitue la base du diagnostic anatomopathologique (typage histologique, grade, stade, limites). De nombreuses techniques complémentaires, morphologiques ou non, peuvent être utilisées pour confirmer ou préciser le diagnostic. D’autres colorations permettant la mise en évidence de particularités des cellules tumorales (ex : mucosécrétion avec le bleu Alcian) ou du stroma (ex : trame réticulinique avec le Gordon-Sweet) sont souvent utiles au diagnostic.
Immunohistochimie
L’immunohistochimie avec des anticorps mono-ou polyclonaux est fréquemment utilisée en pathologie tumorale. L’utilisation de combinaisons d’anticorps dont le choix est orienté par l’étude histologique permet de préciser dans la plupart des cas la nature des tumeurs peu différenciées et l’origine primitive des métastases.
• Des anticorps permettent de déterminer la nature des filaments intermédiaires du cytosquelette des cellules. Ces filaments ont une répartition spécifique au sein des grands types de cellules : filaments de cytokératine dans les cellules épithéliales, filaments de vimentine dans les cellules conjonctives, filaments de desmine dans les cellules musculaires, neurofilaments dans les cellules nerveuses. Ainsi un carcinome est habituellement cytokératine positif et vimentine négatif, alors qu’un sarcome a le phénotype inverse.
• Les marqueurs de surface sont aussi spécifiques de types cellulaires : antigène CD20 (lymphocyte B), antigène épithélial de membrane (cellules épithéliales), Neural Cell Adhesion Molecule (NCAM) (cellules nerveuses et neuro-endocrines), etc.
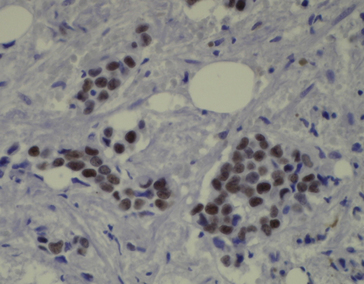
• Des marqueurs cytoplasmiques correspondant à des produits de sécrétion ou des molécules fonctionnelles sont aussi exploités : mucines (adénocarcinomes), chromogranine (cellules neuro-endorines), HMB45 (mélanocytes), thyroglobuline (thyroïde) (figure 7.6).
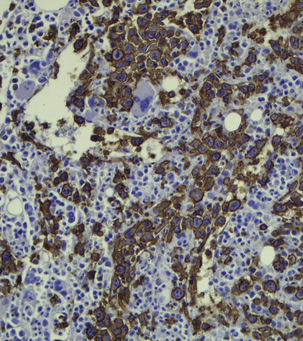
Figure 7.6 Détection de marqueurs de différenciation tumorale par immunohistochimie. Expression du CD20 par les cellules de ce lymphome B à grandes cellules intravasculaire.
Les marqueurs pronostiques ont été abordés dans le chapitre précédent.
Des anticorps dirigés contre des molécules ayant une valeur pronostique ou thérapeutique sont de plus en plus utilisés. Ainsi, la quantification des récepteurs hormonaux dans les noyaux des cellules tumorales de l’adénocarcinome du sein renseigne sur les effets potentiels d’un traitement anti-hormonal (figure 7.7).
Pathologie moléculaire
Les techniques de pathologie moléculaire sont utilisées pour mettre en évidence des altérations moléculaires survenues dans les cellules tumorales. Elles peuvent être réalisées sur coupe histologique (ex : hybridation in situ) ou après extraction de l’un des constituants moléculaire du tissu. Dans ce dernier cas, l’évaluation histologique préalable de la nature du tissu analysé et de sa richesse en cellules tumorales est indispensable.
Les techniques de pathologie moléculaire ont une valeur diagnostique et pronostique dans certaines tumeurs malignes, et peuvent également aider à prévoir la réponse à une thérapie ciblée (théranostique), à dépister la maladie résiduelle après traitement ou à diagnostiquer une prédisposition héréditaire à développer un cancer.
Les altérations génétiques apparaissent successivement au cours de la croissance d’une tumeur. Certaines de ces anomalies sont récurrentes, c’est-à-dire que le même type d’anomalie survient avec une fréquence élevée dans un type de tumeur donné.
Réarrangements chromosomiques
Ces anomalies sont assez fréquentes dans les lymphomes et les sarcomes. Ils peuvent aider au typage des lymphomes (ex : t(14; 18) des lymphomes folliculaires, t(8; 14) des lymphomes de Burkitt, t(2; 5) des lymphomes anaplasiques), des sarcomes (ex : t(X ; 18) des synovialosarcomes) ou des tumeurs pédiatriques (figure 7.8).
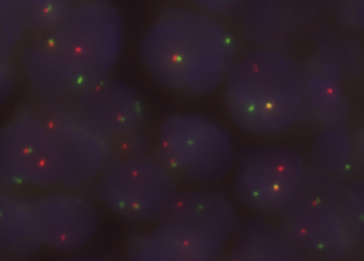
Figure 7.8 Détection par FISH sur noyau interphasique d’une translocation impliquant le proto-oncogène c-myc dans les cellules de ce lymphome. Dans les cellules normales, les signaux vert et rouge sont toujours étroitement associés, alors qu’on observe ici une dissociation, pour un des deux chromosomes, dans la plupart des cellules.
Autres altérations chromosomiques
Il peut s’agir d’anomalies de nombre (ex : hyperploïdie, aneuploïdie), ou de structure (ex : l’isochromosome 17q dans les médulloblastomes). Dans les tumeurs à un stade avancé, ces altérations peuvent être très complexes, et différentes d’une cellule à l’autre (sous-clones).
Amplifications géniques
Elles peuvent avoir une valeur pronostique (ex : mauvais pronostic des neuroblastomes ayant une amplification de c-myc). Elles sont également parfois utiles pour prédire la sensibilité à une thérapie ciblée (ex : HER2 dans des carcinomes mammaires ou gastriques)
L’instabilité génétique
Dans les adénocarcinomes colorectaux, l’instabilité génétique a été opposée à l’instabilité chromosomique. Elle est liée à un défaut de réparation de l’ADN, qui peut être d’origine héréditaire (syndrome de Lynch) ou acquis (formes sporadiques).
Stratégie diagnostique
L’objectif de la prise en charge médicale d’un patient cancéreux est de le traiter le mieux possible, et au moindre coût. Dans la grande majorité des cas, un diagnostic anatomopathologique, avec au minimum un typage de la tumeur, est nécessaire avant le traitement. Toutefois, ceci nécessite le plus souvent un geste invasif qu’il faut mettre en balance avec les risques et l’intérêt pour le patient. Ainsi, chez un patient cirrhotique présentant de volumineux nodules hépatiques et une élévation importante du taux sérique d’alphafœtoprotéine, le diagnostic de carcinome hépatocellulaire est pratiquement certain, et le désagrément et le risque d’une biopsie de confirmation histologique ne sont pas compensés par le bénéfice escompté pour le patient.
Types de prélèvements
Le choix du type de prélèvement est discuté en fonction notamment du patient (état général, antécédents, urgence, souhaits), des hypothèses diagnostiques et des possibilités thérapeutiques.
Prélèvements cytologiques
Par exemple : frottis de lésions cutanéomuqueuses, aspirations bronchiques, cytoponction d’organes profonds. Ils sont les moins invasifs.
Bien que les informations qu’ils apportent soient souvent incomplètes, elles peuvent être rapidement obtenues, et sont souvent utiles pour déterminer le geste le plus approprié pour la suite de la démarche diagnostique (biopsie, chirurgie, chimiothérapie première). Elles sont parfois suffisantes pour décider de la thérapeutique.
Biopsies par voies endoscopiques
Elles sont assez peu invasives et permettent souvent un diagnostic (ex : typage d’une tumeur bronchique, gastrique ou colique). Le résultat est fiable et l’ensemble du traitement peut être fondé dessus (ex : lymphome gastrique, carcinome bronchique à petites cellules, adénocarcinome colique).
Biopsies d’organes profonds
Elles constituent une alternative pour les organes pleins (ex : nodule hépatique ou pancréatique).
Prélèvements chirurgicaux
Ils sont les plus invasifs. Il faut toutefois encore distinguer les prélèvements à visée uniquement diagnostique qui peuvent être de petite taille, (ex : biopsie ganglionnaire ou médiastinale) et les résections à but thérapeutique. Ce sont ces derniers prélèvements qui fourniront le plus d’informations (ex : le stade d’un adénocarcinome colique dans une iléo-colectomie).
Collaboration au sein de l’équipe médicale
Le médecin qui prescrit ou effectue un prélèvement en vue d’un examen anatomopathologique doit toujours garder à l’esprit que celui-ci doit permettre de faire un diagnostic. Ce prélèvement doit donc être :
• aussi représentatif que possible de la tumeur ;
• acheminé dans les conditions appropriées, c’est-à-dire soit dans du fixateur si ce médecin est certain qu’un fragment tumoral frais ne sera pas nécessaire, soit à l’état frais (transport en moins de 30 min et en atmosphère humide) ;
• associé à des informations cliniques qui permettront au pathologiste de le redistribuer pour des techniques appropriées (ex : biologie moléculaire, caryotype).
En cas de doute, il est souvent utile de discuter avec le pathologiste concerné avant d’effectuer le prélèvement.
Après avoir fait une synthèse des lésions macro- et microscopiques et, le cas échéant, des altérations moléculaires, le pathologiste confronte ses conclusions avec les données cliniques, radiologiques et biologiques afin d’établir un diagnostic définitif.
Définition, composition et classification des tumeurs
Une tumeur, ou néoplasme, est une masse tissulaire due à une prolifération cellulaire excessive reproduisant plus ou moins fidèlement un tissu normal ou embryonnaire, et ayant tendance à persister ou croître spontanément. Une tumeur peut être plus ou moins bien différenciée, selon qu’elle ressemble ou non au tissu d’origine.
Tout cancer est constitué de cellules tumorales (cellules proliférantes anormales) et du stroma qui correspond à l’ensemble des cellules non tumorales présentes en son sein. Les cellules du stroma ne présentent pas les anomalies génétiques des cellules tumorales.
Les tumeurs sont classées en fonction de l’organe où elles se développent initialement (= « primitif ») et du type histologique, c’est-à-dire du tissu qu’elles tendent à reproduire. L’examen anatomopathologique doit également évaluer le potentiel évolutif d’une tumeur et notamment, pour les tumeurs malignes, le stade et le grade.
La classification et la caractérisation des tumeurs nécessitent, dans la majorité des cas, l’examen d’un prélèvement tissulaire biopsique ou chirurgical. Le diagnostic est alors réalisé sur des coupes histologiques colorées à l’HES, complétées si besoin par des techniques complémentaires histologiques (colorations « spéciales », immunohistochimie, hybridation in situ), ou moléculaires réalisées après amplification de l’ADN génomique ou complémentaire.
La stratégie diagnostique, c’est-à-dire le choix du prélèvement et des techniques les plus appropriées à la situation du patient nécessitent de bien connaître les avantages et les limites de chaque méthode. Une interaction directe entre les médecins ou chirurgiens ayant en charge le patient et le médecin pathologiste réalisant le diagnostic est nécessaire avant la mise en œuvre d’un traitement, et parfois également pour le choix de la stratégie diagnostique.
Pour les entraînements du chapitre 7, cf. p.182.